
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是
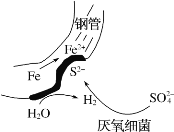
A.正极的电极反应式为O2+4e-+2H2O=4OH-
B.钢管腐蚀的直接产物中含有FeS、Fe(OH)2
C.SO42-与H2的反应可表示为4H2+SO42--8e- S2-+4H2O
S2-+4H2O
D.在钢管表面镀锌或铜可减缓钢管的腐蚀
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】在容积为2 L的恒容密闭容器中充入1 mol CO2(g)和3.5 mol H2(g),在一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。反应进行8 min时达到平衡状态,测得n(CH3OH)=0.5mol。该反应的平衡常数K与温度T的关系如图1所示,CO2的转化率如图2所示,下列说法错误的是
CH3OH(g)+H2O(g) ΔH<0。反应进行8 min时达到平衡状态,测得n(CH3OH)=0.5mol。该反应的平衡常数K与温度T的关系如图1所示,CO2的转化率如图2所示,下列说法错误的是

A. 在图1中,曲线Ⅱ表示该反应的平衡常数K与温度T的关系
B. 该温度下,平衡常数K=0.25
C. 其他条件不变下,图2中x可表示温度或压强或投料比c(CO2)/c(H2)
D. 用二氧化碳合成甲醇体现了碳减排理念
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
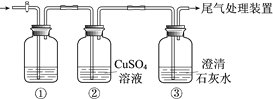
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2SO2(g)+O2(g)![]() 2SO3(g)。在反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是( )
2SO3(g)。在反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是( )
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1B.SO2为0.35 mol·L-1
C.SO3为0.4 mol·L-1D.SO2、SO3均为0.15 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种生物电化学方法脱除水体中NH4+的原理如下图所示:
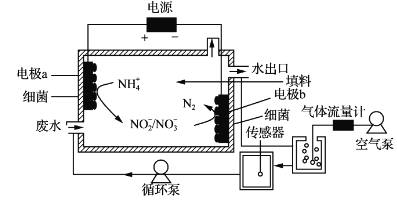
下列说法正确的是
A. 装置工作时,化学能转变为电能
B. 装置工作时,a极周围溶液pH降低
C. 装置内工作温度越高。NH4+脱除率一定越大
D. 电极b上发生的反应之一是:2NO3--2e-=N2↑+3O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环结构中,不存在碳碳单键和碳碳双键的简单交替结构,可以作为证据的事实是( )
①苯不能使酸性KMnO4溶液褪色
②苯分子中碳碳键的长度完全相等
③苯能在加热和催化剂存在的条件下与氢气发生反应生成环己烷(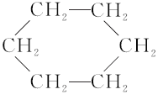 )
)
④经实验测得对二甲苯(![]() )只有一种结构
)只有一种结构
⑤苯在溴化铁作催化剂条件下同液溴可发生取代反应,但不能因化学反应而使溴水褪色
A. ②③④B. ②④⑤C. ①③⑤D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,锂离子电池是目前应用广泛的一类电池。以钛铁矿(主要成分为FeTiO3,含有少量MgO、Fe2O3、SiO2等杂质)为原料,制备锂离子电池电极材料的工艺流程如图所示:
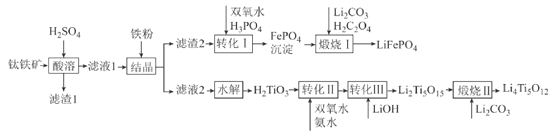
已知:①滤液1中含Ti微粒的主要存在形式为TiO2+;
②)Ksp(FePO4)=1.3×10-22、Ksp[Mg3(PO4)2]=1.0×10-24;溶液中某离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。
请回答下列问题:
(1)滤渣1中主要成分的化学式为__。
(2)“结晶”温度需控制在70℃左右,若温度过高会导致的后果为__。
(3)“转化I”后所得溶液中c(Mg2+)=0.01mol·L-1,若其中Fe3+沉淀完全,则溶液中c(PO43-)的范围为__。
(4)“煅烧I”反应中氧化剂和还原剂的物质的量之比为__。
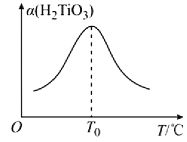
(5)“转化II”中H2TiO3的转化率(α)与温度(T)的关系如图所示。T0℃时,一定时间内H2TiO3的转化率最高的原因为__。
(6)Li2Ti5O15中-1价与-2价O原子的数目之比为___。“煅烧II”反应中同时生成两种参与大气循环的气体,该反应的化学方程式为__。
(7)某锂离子电池放电时的电池反应为Li1-xFePO4+LixC6=LiFePO4+6C,则充电时阳极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1)配制100mL 0.1000mol/L NaOH标准溶液。
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.1000 | 30.05 | 20.00 |
2 | 0.1000 | 29.95 | 20.00 |
3 | 0.1000 | 28.20 | 20.00 |
①滴定达到终点的判断是________,此时锥形瓶内溶液的pH为_____________。
②根据上述数据,可计算出该盐酸的浓度约为___________(保留四位有效数字)
③排去碱式滴定管中气泡的方法应采用操作__________,然后轻轻挤压玻璃球使尖嘴部分充满碱液
甲.![]() 乙.
乙.![]() 丙.
丙.![]()
④在上述实验中,下列操作(其他操作正确)会造成盐酸浓度测定结果偏高的有_____
A、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
B、锥形瓶水洗后未干燥
C、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D、配制NaOH标准溶液时,移液后未洗涤烧杯和玻璃棒
E、碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质工业制法的叙述错误的是
A.陶瓷、玻璃、水泥的生产中均用到了石灰石
B.工业制备高纯硅涉及的主要反应中,所有的反应均为氧化还原反应
C.工业制硫酸过程中,常用98.3%的浓硫酸吸收SO3
D.氨催化氧化是工业制硝酸的基础
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com