
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1)配制100mL 0.1000mol/L NaOH标准溶液。
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.1000 | 30.05 | 20.00 |
2 | 0.1000 | 29.95 | 20.00 |
3 | 0.1000 | 28.20 | 20.00 |
①滴定达到终点的判断是________,此时锥形瓶内溶液的pH为_____________。
②根据上述数据,可计算出该盐酸的浓度约为___________(保留四位有效数字)
③排去碱式滴定管中气泡的方法应采用操作__________,然后轻轻挤压玻璃球使尖嘴部分充满碱液
甲.![]() 乙.
乙.![]() 丙.
丙.![]()
④在上述实验中,下列操作(其他操作正确)会造成盐酸浓度测定结果偏高的有_____
A、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
B、锥形瓶水洗后未干燥
C、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D、配制NaOH标准溶液时,移液后未洗涤烧杯和玻璃棒
E、碱式滴定管尖嘴部分有气泡,滴定后消失
【答案】滴入最后一滴NaOH标准溶液,锥形瓶中溶液由无色变成浅红色,且30s不褪色 8.2~10.0 0.1500 mol/L 丙 CDE
【解析】
①用氢氧化钠溶液滴定盐酸的实验中,选用酚酞作指示剂时,滴入最后一滴NaOH溶液时,溶液显碱性,结合酚酞的性质分析解答;②根据c(酸)×V(酸)=c(碱)×V(碱)计算;③碱式滴定管的气泡通常在橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出;④根据c(待测)= ![]() 分析误差。
分析误差。
①在用氢氧化钠溶液滴定盐酸的实验中,选用酚酞作指示剂时,当滴入最后一滴NaOH溶液时,溶液颜色恰好由无色变为(浅)红色,且半分钟内不褪色,说明达到了滴定终点;酚酞的变色范围是8.2~10,所以滴定终点时溶液pH为8.2~10;故答案为:滴入最后一滴氢氧化钠溶液,溶液由无色恰好变成浅红色,且半分钟内不褪色;8.2~10;
②根据表格数据可知,第三次实验误差较大,删去,根据c(酸)×V(酸)=c(碱)×V(碱),消耗的V[NaOH(aq)]=![]() mL=30.00mL,则该盐酸的浓度为:
mL=30.00mL,则该盐酸的浓度为:![]() =0.15mol/L,故答案为:0.15mol/L;
=0.15mol/L,故答案为:0.15mol/L;
③碱式滴定管的气泡通常在橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡排出,图示丙操作合理,故答案为:丙;
④A.酸式滴定管水洗后未用待测稀盐酸溶液润洗,会导致盐酸浓度偏低,需要NaOH体积偏小,测定值偏低,故A错误;B.锥形瓶水洗后直接装待测液,锥形瓶中HCl的物质的量不变,消耗的NaOH的量不变,对实验无影响,故B错误;C、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,导致消耗的NaOH体积偏大,测定值偏高,故C正确;D、配制NaOH标准溶液时,移液后未洗涤烧杯和玻璃棒,导致氢氧化钠溶液的浓度偏小,消耗的NaOH体积偏大,测定值偏高,故D正确;E.碱式滴定管尖嘴部分有气泡,滴定后消失,会导致消耗的NaOH体积偏大,测定值偏高,故E正确;故答案为:CDE。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】用新型甲醇燃料电池作电源电解硫酸铜溶液,下列有关说法不正确的是( )
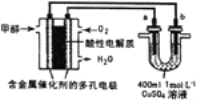
A.甲醇一极的电极反应式为CH3OH-6e-+H2O= CO2↑+6H+
B.若a为粗钢,b为精铜,消耗标准状况下224mL O2,则a极质量减少1.28g
C.若a. b均为石墨,a极反应为:2H2O-4e-= 4H+ +O2↑
D.若a为石墨,b为铜,消耗标准状况下224mLO2,则电解后CuSO4溶液的pH为1(忽略溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是
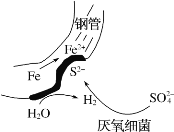
A.正极的电极反应式为O2+4e-+2H2O=4OH-
B.钢管腐蚀的直接产物中含有FeS、Fe(OH)2
C.SO42-与H2的反应可表示为4H2+SO42--8e- S2-+4H2O
S2-+4H2O
D.在钢管表面镀锌或铜可减缓钢管的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
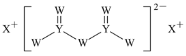
A.元素非金属性强弱的顺序为W>Y>Z
B.Y单质的熔点高于X单质
C.W分别与X、Y、Z形成的二元化合物均只有一种
D.化合物M中W不都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeCl3的水溶液呈___________(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):____________________________________________,
(2)实验室在配制好的FeCl3溶液中加少许稀盐酸的目的是:__________________ 。
(3)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是__________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
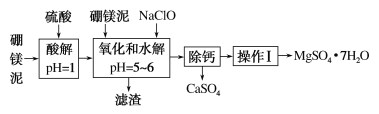
根据题意回答下列问题:
(1)实验中需用1 mol·L-1的硫酸800 mL,若用18.4 mol·L-1的浓硫酸来配制,量取浓硫酸时,需使用的量筒的规格为________。
A 10 mL B 20 mL C 50 mL D 100 mL
(2)加入的NaClO可将Mn2+氧化为MnO2,反应的离子方程式为:___________________,还有一种离子也会被NaClO氧化,反应的离子方程式为______________________。
(3)滤渣的主要成分中除含有Fe(OH)3、Al(OH)3外还有_______________。
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法:____________________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 |
S(MgSO4)/g | 30.9 | 33.4 | 35.6 | 36.9 |
S(CaSO4)/g | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4的混合溶液中的CaSO4除去,根据上表数据,可确定操作步骤为蒸发结晶、________________(填操作名称)。
(6)实验中提供的硼镁泥共10 g,得到MgSO4·7H2O共17.22 g,则MgSO4·7H2O的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知向某溶液中逐滴加入NaOH溶液时,测得生成沉淀的质量随所加入NaOH的体积变化如图所示,则该溶液中大量含有的离子可能是()
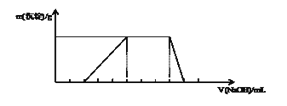
A. H+、NH4+、Mg2+、NO3-
B. H+、Al3+、AlO2-、NH4+
C. H+、NH4+、Al3+、Cl-
D. NH4+、Al3+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家意外发现一种罕见无机化合物YZX2W3(结构如图所示) ,其中W、X、Y为同一短周期元素, X、Z为短周期同一主族元素且Z的核电荷数是X的2倍,下列说法正确的是

A.元素非金属性强弱顺序为X>Y> W
B.Z的氧化物的水化物是强酸
C.NaY的水溶液不能存放在玻璃试剂瓶中
D.X与Z具有相同的最高化合价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
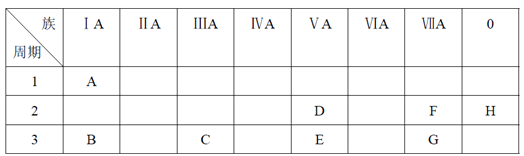
根据A~G元素在周期表中的位置,用化学式填写空白。
(1)氧化性最强的单质是______,还原性最强的单质是______,化学性质最不活泼的单质是______。(填相应的化学式)
(2)最稳定的氢化物是______。(填相应的化学式)
(3)一个E原子的核外电子总共有______种运动状态。
(4)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是_______。(填相应的化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com