
【题目】下列属于化合反应的是
A.Zn+2AgNO3=Zn(NO3)2+2AgB.2FeCl2+Cl2=2FeCl3
C.Cu(OH)2+2HCl=CuCl2+2H2OD.CaCO3![]() CaO+CO2↑
CaO+CO2↑
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】化学反应不仅有物质变化,同时还伴随着能量的变化,化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)在25℃、101KPa下,1gCH3OH与氧气充分反应,生成二氧化碳气体和水时释放出22.68kJ的热量,则表示甲醇燃烧热的热化学方程式为:_____。
(2)已知已知葡萄糖的燃烧热是2804kJ/mol,当它氧化生成1g液态水时放出的热量是__________ kJ(结果保留两位小数)
(3)已知热化学方程式C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220 kJ/mol,2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
①现有H2和C3H8的混合气体共5mol,完全燃烧时放热3472.9kJ,则混合气体中H2和C3H8的体积比为__________。
②1mol H2和2 mol C3H8组成的混合气体共完全燃烧时放热_________ kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对高温条件下反应机理的研究一直是化学动力学的重要课题,科研工作者研究了1000K下丙酮的热分解反应并提出了如下反应历程:
![]() ①
①![]()
![]() ②
②![]()
![]() ③
③![]()
![]() ④
④![]()
![]() ⑤
⑤![]()
回答下列问题:
(1)上述历程是根据两个平行反应提出的,其中一个为CH3COCH3![]() CH4+CH2=C=O,该反应的快慢主要由上述历程中的反应______(填序号)决定,另一个反应的化学方程式为____________________________,反应速率常数k4______k5。(填“>”或“<”)。
CH4+CH2=C=O,该反应的快慢主要由上述历程中的反应______(填序号)决定,另一个反应的化学方程式为____________________________,反应速率常数k4______k5。(填“>”或“<”)。
(2)CH2=C=O(乙烯酮)可以与乙醇发生加成反应生成酯,写出该反应的化学方程式:____________________________________。
(3)一定温度下,在2L密闭容器中充入1molCH3COCH3发生上述两个平行反应,提高乙烯酮反应选择性的关键因素是___________;
a.再充入1molCH3COCH3 b.及时分离出CH4 c.使用适宜的催化剂
达到平衡后,测得容器中存在a molCH4和b mol CO,则CH3COCH3(g)![]() CH4(g)+CH2=C=O(g)在该温度下的平衡常数K_____mol·L-1(用含a、b的代数式表示)。
CH4(g)+CH2=C=O(g)在该温度下的平衡常数K_____mol·L-1(用含a、b的代数式表示)。
(4)分解产物中的CH4可用于制备氢气:
反应I:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=206.2kJ·mol-1
CO(g)+3H2(g) △H=206.2kJ·mol-1
反应Ⅱ:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=165.0kJ·mo1-1
CO2(g)+4H2(g) △H=165.0kJ·mo1-1
写出CO与水蒸气反应生成CO2的热化学方程式:_________________。830℃时,反应Ⅱ的平衡常数K=1.2mol2·L-2,该温度下,测得密闭容器中各物质的浓度为c(CH4)=2.0mol·L-1、c(H2O)=4.0mol·L-1、c(CO2)=2.0mol·L-1、c(H)=2.0mol·L-1,则此时v正_____v逆(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法不正确的是
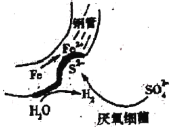
A.正极的电极反应式为:2H2O+2e-=H2+2OH-
B.SO42-与H2的反应可表示为:4H2+SO42- S2-+4H2O
S2-+4H2O
C.钢管腐蚀的直接产物中含有FeS、Fe(OH)3
D.在钢管表面镀锌可减缓钢管的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.常温下,0.5L 1.0 mol·L-1Na2SO4溶液中含有的氧原子数为2NA
B.标况下,11.2 L H2O所含电子数为5NA
C.2.4 g镁变为镁离子时失去的电子数为0.1NA
D.常温常压下,32g氧气和臭氧的混合物中所含氧原子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的化肥的主要成分及相关性质。首先对该化肥的成分进行了如下假设:
a.只含有FeSO4
b.含有FeSO4和Fe2(SO4)3
c.只含有Fe2(SO4)3
将化肥固体粉末溶于水中得到溶液(记为X),进行如下实验:
实验序号 | 操作 | 现象 |
ⅰ | 取2 mL溶液X,加入1 mL 1 mol·L-1 NaOH溶液 | 产生红褐色沉淀 |
ⅱ | 取2 mL溶液X,加入1滴KSCN | 溶液显红色 |
(1)请用文字表述做出假设b的依据是__________________________。
(2)对实验ⅰ的预期现象是产生白色沉淀、变为灰绿色、最后出现红褐色沉淀,预期产生该现象的依据是(用化学方程式或离子方程式表达)_____、_____。
(3)由实验ⅱ得出的结论是____________。结合实验ⅰ、ⅱ,推测实验ⅰ实际现象与预期现象不符的原因可能是_____________________________。为进一步验证假设,小组同学进行了以下实验:
实验序号 | 操作 | 现象 |
ⅲ | 取2 mL溶液X,加入1滴KSCN,再加入1 mL水 | 溶液显红色 |
ⅳ | 取2 mL溶液X,加入1滴KSCN,再加入1 mL氯水 | 溶液显红色,颜色比ⅲ深 |
(4)实验ⅳ中氯水参加反应的离子方程式是_______________________。
(5)通过以上实验,可得到的结论是_____________________________,请完整表达该结论是如何得出的_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
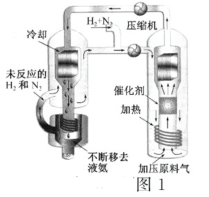
【题目】(一)合成氨工艺(流程如图1所示)是人工固氮最重要的途径。2018年是合成氨工业先驱哈伯(F·Haber)获得诺贝尔奖100周年。
N2和H2生成NH3的反应为:![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)△H(298K)=-46.2kJ·mol-1
NH3(g)△H(298K)=-46.2kJ·mol-1
在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)![]() 2H*
2H*
表面吸附:N*+H*![]() NH*;NH*+H*
NH*;NH*+H*![]() NH2*;NH2*+H*
NH2*;NH2*+H*![]() NH3*
NH3*
脱附:NH3*![]() NH3(g)
NH3(g)
其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
请回答:
(1)利于提高合成氨平衡产率的条件有_______________
A.低温B.高温C.低压D.高压E.催化剂
(2)标准平衡常数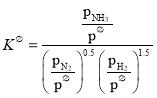 ,其中
,其中![]() 为标准压强1×105Pa,
为标准压强1×105Pa,![]() 、
、![]() 和
和![]() 为各组分的平衡分压,如
为各组分的平衡分压,如![]() =
=![]() p,p为平衡总压,
p,p为平衡总压,![]() 为平衡系统中NH3的物质的量分数
为平衡系统中NH3的物质的量分数
①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为ω,则![]() =____________(用含ω的最简式表示)
=____________(用含ω的最简式表示)
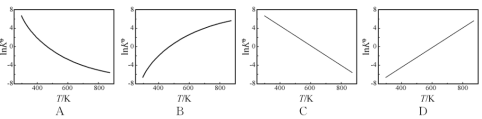
②图中可以示意标准平衡常数K随温度T变化趋势的是____________
(3)实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8
①分析说明原料气中N2过量的理由____________
②关于合成氨工艺的下列理解,正确的是____________
A.合成氨反应在不同温度下的△H和△S都小子零
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
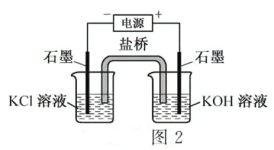
(二)高铁酸钾(K2FeO4)可用作水处理剂口某同学通过“化学一电解法”探究K2FeO4的合成,其原理如图2所示.接通电源,调节电压,将一定量C12通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4
(1)请写出“化学法”得到FeO42一的离子方程式____________
(2)请写出阳极的电极反应式(含FeO42-)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
A. 处于平衡状态,正逆反应速率相等B. 改变条件后,化学平衡常数一定改变
C. 反应逆向进行,正反应速率小于逆反应速率D. 升高温度,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CS2是一种常见溶剂,还可用于生产人造粘胶纤维等。回答下列问题:
(1)CS2与酸性KMnO4溶液反应,产物为CO2和硫酸盐,该反应中还原剂与氧化剂的物质的量之比为__________(MnO4-被还原为Mn2+)。
(2)甲烷硫磺法制取CS:的反应为CH4(g)+2S2(g)![]() CS2(g)+2H2S(g) △H
CS2(g)+2H2S(g) △H
①在恒温恒容密闭容器中进行该反应时,能说明该反应已达到平衡状态的是_________(填字母)。
A.v正(S2)=2v逆(CS2)
B.容器内气体的密度不再随时间变化
C.容器内气体的总压强不再随时间变化
D.单位时间内断裂C-H键数目与断裂H-S键数目相等
②已知下列键能数据:
共价键 | C-H | S=S | C=S | H-S |
键能/ | 411 | 425 | 573 | 363 |
该反应的△H=_________kJ·mol-1。
(3)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
CS2(g)+4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
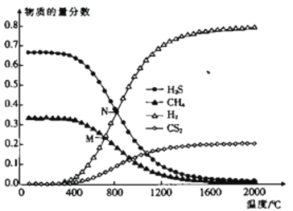
①该反应△H_________(填“>”或“<”)0。
②M点对应温度下,H2S的平衡转化率为_________,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是___________________________(列举一条)。
③N点,平衡分压p(CS2)=_________MPa,对应温度下,该反应的Kp=_________(MPa)2。(Kp为以分压表示的平衡常数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com