
【题目】下列表示对应化学反应的离子方程式正确的是
A. 将Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-
B. 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH+OH-![]() NH3↑+H2O
NH3↑+H2O
C. 将过量SO2通入冷氨水中:SO2+NH3·H2O===HSO+NH
D. 用稀硝酸洗涤试管内壁上附着的银:Ag+2H++NO===Ag++NO↑+H2O
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】根据下列框图分析,下列说法正确的是( ) 
A.E2+的氧化性比M2+的氧化性强
B.在③反应中加稀硫酸可抑制Fe2+的水解
C.反应④的离子方程式可表示为:E3++3SCN﹣E(SCN)3↓
D.在反应①中只能用浓硫酸,既表现了酸性、又表现了氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A 元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料一一光导纤维,C 与烧碱反应生成含A 元素的化合物D。
(1)写出C与氢氟酸发生反应的化学方程式是_____________________________
(2)将C与纯碱混合高温熔融时反应生成D,同时还生成氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①分别写出生成D和F的化学方程式:_______________________、_________________________。
②要将NaOH高温熔化,下列坩埚中可选用的是______________________________。
a.普通玻璃坩埚 b.石英玻璃坩埚 c.氧化铝坩埚 d.铁坩埚
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2。现将20.0g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L。生成氢气的离子方程式为______________________________,硅酸盐的物质的量浓度为__________mol/L。
(4) 下列叙述正确的有_______(填序号)。
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
③钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题: 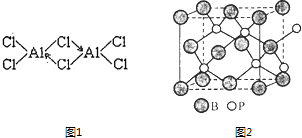
(1)写出基态镓原子的电子排布式 .
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),结构如图1缔合双分子Al2Cl6中Al原子的轨道杂化类型是 .
(3)B原子的电子有个不同的能级;晶体硼熔点为2300℃,则其为晶体.
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得.BP晶胞如图2所示. ①画出三溴化硼和三溴化磷的空间结构式.
三溴化硼三溴化磷
②在BP晶胞中B的堆积方式为 .
③计算当晶胞晶格参数为apm(即图中立方体的每条边长为apm)时,磷化硼中硼原子和磷原子之间的最近距离 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( ) 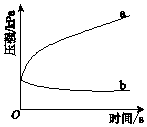
A.两容器中负极反应均为Fe﹣2e﹣═Fe2+
B.曲线a记录的是pH=2的盐酸中压强的变化
C.曲线b记录的容器中正极反应是O2+4e﹣+2H2O═4OH﹣
D.在弱酸性溶液中,生铁能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价的砷(As)元素,但它对人体是无毒的,砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C=砒霜.下面有关解释不正确的应该是
A.青菜中含有维生素C
B.维生素C具有还原性
C.致人中毒过程中砷发生还原反应
D.砒霜是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100 mL 0.3 mol/L和300 mL 0.25 mol/L的硫酸注入500 mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是 ( )
A. 0.21 mol/L B. 0.42 mol/L C. 0.56 mol/L D. 0.26 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某物质中加入氢氧化钠溶液后加热产生能使湿润红色石蕊试纸变蓝的气体,若加入盐酸溶液,产生能使澄清石灰水变浑浊的气体,则该物质不可能是
A.NH4HCO3B.(NH4)2CO3C.(NH4)2SO4D.(NH4)2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。
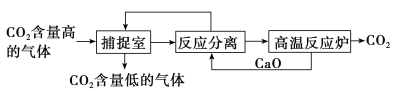
下列有关该方法的叙述中正确的是
①能耗大是该方法的一大缺点
②“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
③该方法可减少碳排放,捕捉到的CO2还可用来制备干冰等产品
④整个过程中,只有一种物质可以循环利用
A.①② B.①③ C.②③ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com