
【题目】将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一固定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 ![]() 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2 , 气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题(计算结果保留一位小数):
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2 , 气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题(计算结果保留一位小数):
(1)判断该反应达到平衡状态的标志是。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.向装置中再充入SO3
(3)求该反应达到平衡时SO2的转化率为(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的Ba(OH)2溶液,生成沉淀。
【答案】
(1)bc
(2)b
(3)94.7%
(4)10.5g或0.045mol或BaSO4
【解析】(1)a.可逆反应到达平衡时SO2和SO3浓度不一定相等,与二氧化硫的起始浓度以及转化率有关,a不符合题意;
b.可逆反应达到平衡状态时,各物质的百分含量不变,SO2百分含量保持不变,说明到达平衡状态,b符合题意;
c.随反应进行气体的物质的量减小,恒温恒容下,容器内气体压强减小,当容器中气体的压强不变,说明到达平衡状态,c符合题意;
d.SO3的生成速率与SO2的消耗速率都表示正反应速率,反应始终二者都按1:1进行,不能说明到达平衡状态,d不符合题意;
e.混合气体的质量不变,容器的体积不变,所以密度始终不变,不能说明到达平衡状态,e不符合题意;
(2)a.向装置中再充入N2 , 反应物和生成物的浓度不变,平衡不移动,所以不能提高转化率,a不符合题意;
b.向装置中再充入O2 , 氧气浓度增大,平衡向正反应方向移动,提高了二氧化硫的转化率,b符合题意;
c.改变反应的催化剂只改变反应速率,不改变平衡,所以不能提高二氧化硫的转化率,c不符合题意;
d.向装置中再充入SO3 , 平衡向逆反应方向移动,降低了二氧化硫的转化率,d不符合题意;
(3)混合气体通过过量NaOH溶液时,减少的气体是二氧化硫和三氧化硫,所以三氧化硫和未参加反应的二氧化硫的体积是21.28L,剩余氧气的体积是5.6L,则参加反应的氧气的体积=0.7mol×22.4L/mol-5.6L=10.08L,根据二氧化硫、三氧化硫和氧气的关系式知,参加氧化还原反应的二氧化硫的体积=10.08L×2=20.16L,生成三氧化硫的体积=10.08L×2=20.16L,则未参加氧化还原反应的二氧化硫的体积=21.28L-20.16L=1.12L,原来二氧化硫的体积=20.16L+1.12L=21.28L,所以二氧化硫的转化率=20.16L/21.28L×100%=94.7%;
(4)依据(3)的计算可知混合气体中生成三氧化硫气体物质的量为0.9mol,在给定的条件下,溶液呈强酸性,BaSO3不会沉淀。因此BaSO4的质量=0.9mol×5%×233g/mol=10.5g。
故答案为:(1)bc;(2)b;(3)94.7%;(4)10.5g或0.045mol或BaSO4
(1)当可逆反应达到平衡状态时,则其正逆反应速率相等,反应体系中各物理量保持不变,据此分析选项;
(2)欲提高SO2的转化率,则应使平衡向正反应方向移动,结合平衡移动原理分析即可;
(3)平衡转化率=平衡时参与反应的量÷起始加入的量×100%,据此结合题干数据,从三段式入手进行计算;
(4)由平衡三段式的计算可知,反应后混合气体中含有SO2、SO3(0.9mol),且溶液显酸性,因此形成的沉淀应为BaSO4 , 结合反应的方程式可计算出沉淀的量;


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】苹果酸广泛存在于苹果等水果的果肉中是一种常用的食品添加剂。经测定,草果酸的相对分子质量为134,所含各元素的质量分数为w(C)=35.82%,w(H)=4.48%、w(O)=59.70%。其中存在5种不同化学环境的H原子。以乙烯为原料人工合成草果酸的线路如图所示:
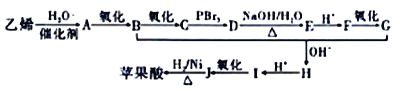
已知:①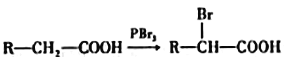
②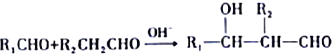
请回答下列问题:
(1)苹果酸的分子式为_______,B物质的名称为_______。F中含有的官能团名称是_______。
(2)G+B→H的反应类型是____________。I 的结构简式为___________________。
(3)D→E反应的化学方程式为________________________________。
(4)1mol苹果酸能与________molNaHCO3完全反应,能与足量的Na反应生成_______LH2(标况下)。
(5)与苹果酸含有相同种类和数量的官能团的同分异构体的结构简式为_________;其所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是__________(填序号)。
a. 元素分析仪 b.红外光谱仪 c. 质谱仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够高效低能耗地实现CO2的分离和捕获其原理如下图所示:
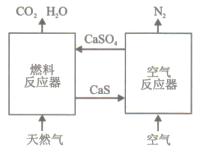
(1)已知在燃料反应器中发生如下反应:
i.4CaSO4(s)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为_________(填“i”“ii”或“ⅲ”)。
②反应i和ii的平衡常数Kp与温度的关系如图1,则a_______0(填“ >”“ =“或“<” );720℃时反应ⅲ的平衡常数Kp=________。
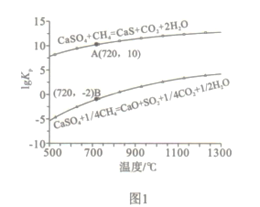
③下列措施可提高反应ii中甲烷平衡转化率的是_______。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.降温 D.增大甲烷流量
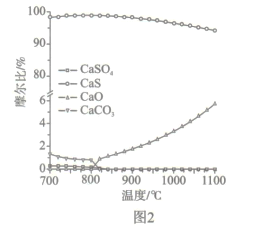
(2)如图2所示,该燃料反应器最佳温度范围为850℃ -900℃之间,从化学反应原理的角度说明原因:_______。
(3)空气反应器中发生的反应为
CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为__________反应。
②在天然气燃烧过程中,可循环利用的物质为________。
(4)该原理总反应的热化学方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125 ℃,反应装置如图,下列对该实验的描述错误的是( )
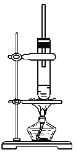
A. 不能用水浴加热
B. 长玻璃管起冷凝回流作用
C. 提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D. 图中装置不能较好的控制温度为115~125 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如图所示。回答下列问题:
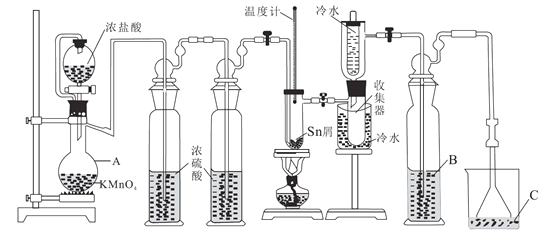
已知:①SnCl4在空气中极易水解生成SnO2·хH2O
②
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
(1)仪器A的名称是_______,其中发生反应的离子方程式是____________。
(2)点燃酒精灯前需排尽装置中的空气,否则会发生副反应,化学方程式是______、_____。
(3)试剂 B、C依次为_______,试剂B的作用是______。
(4)Cl2 和锡的反应产物有SnCl4和SnCl2,为防止产品中带入 SnCl2,可采取的措施是_______、_______。
(5)碘氧化法滴定分析产品中2价Sn(II)的含量。准确称取m g产品于锥形瓶中,用蒸馏水溶解,淀粉-KI溶液做指示剂,用c mol·L-1 碘标准溶液滴定至终点,消耗碘标准溶液V mL,计算产品中Sn(II)的含量_______(用含c、m、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是丁烷裂解的实验流程:(提示:丁烷在一定条件下裂解的可能方程式为:C4H10![]() C2H6+C2H4, C4H10
C2H6+C2H4, C4H10![]() CH4+C3H6)
CH4+C3H6)
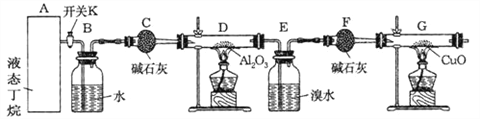
连接好装置后,需进行的实验操作有:
①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等…
(1)这三步操作的先后顺序依次是_______________________(填序号)
(2)写出甲烷与氧化铜反应的化学方程式______________________
(3)若对E装置中的混合物(溴水足量),再按以下流程实验:
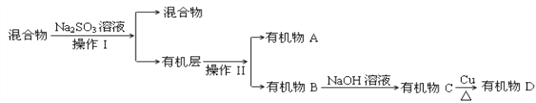
①分离操作Ⅰ和Ⅱ的名称分别是:Ⅰ________Ⅱ________,Na2SO3溶液的作用是(用离子方程式表示)________________________________________________________.
②已知B的碳原子数大于A的碳原子数,请写出B的结构简式_____________________.
(4)假定丁烷完全裂解,当(E+F)装置的总质量比反应前增加了0.7 g, G装置的质量减少了1.76 g,则丁烷的裂解产物中甲烷和乙烷的物质的量之比 n(CH4): n(C2H6)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,与对应的叙述相符的是
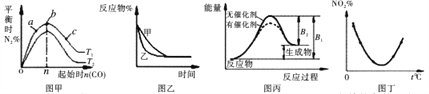
A. 图甲表示反应:4CO(g) +2NO2(g)==N2(g) +4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1<T2,b点处NO2的转化率最大
B. 图乙表示某条件对2A(g) +B(g)==3C(g)的影响,乙一定使用了催化剂
C. 图丙表示的某可逆反应是吸热反应,该图表明催化剂能同时改变正逆反应的活化能
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH>0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的①—⑥六种元素,回答下列问题:
族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ |
(1)画出元素④的原子结构示意图__________;
(2)元素①形成的最简单有机物的化学式是__________;
(3)表中所列元素中非金属性最强的元素是__________(填元素符号)
(4)元素⑤形成的最高价氧化物对应的水化物的化学式是__________;
(5)元素③和元素⑥形成的化合物的电子式是__________。
(6)表中所列元素中金属性最强的元素是__________(填元素符号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com