
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如图所示。回答下列问题:
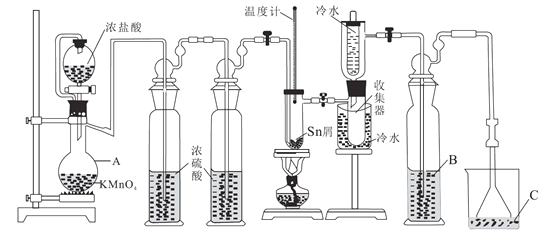
已知:①SnCl4在空气中极易水解生成SnO2·хH2O
②
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
(1)仪器A的名称是_______,其中发生反应的离子方程式是____________。
(2)点燃酒精灯前需排尽装置中的空气,否则会发生副反应,化学方程式是______、_____。
(3)试剂 B、C依次为_______,试剂B的作用是______。
(4)Cl2 和锡的反应产物有SnCl4和SnCl2,为防止产品中带入 SnCl2,可采取的措施是_______、_______。
(5)碘氧化法滴定分析产品中2价Sn(II)的含量。准确称取m g产品于锥形瓶中,用蒸馏水溶解,淀粉-KI溶液做指示剂,用c mol·L-1 碘标准溶液滴定至终点,消耗碘标准溶液V mL,计算产品中Sn(II)的含量_______(用含c、m、V的代数式表示)。
【答案】 蒸馏烧瓶 2MnO4-+16H++10C1-=2Mn2++5C12↑+8H2O SnCl4 +(x+2)H2O=SnO2·xH2O↓+ 4 HCl↑ Sn+O2![]() SnO2 浓硫酸 氢氧化钠溶液 防止C溶液的水进入收集器 控制Sn与氯气的反应温度在232℃至650℃之间 过量氯气 (11.9cV/m)%
SnO2 浓硫酸 氢氧化钠溶液 防止C溶液的水进入收集器 控制Sn与氯气的反应温度在232℃至650℃之间 过量氯气 (11.9cV/m)%
【解析】(1)仪器A的名称是蒸馏烧瓶,其中浓盐酸和高锰酸钾反应生成氯化锰、氯气和水,发生反应的离子方程式是:2MnO4-+16H++10C1-=2Mn2++5C12↑+8H2O;(2)点燃酒精灯前需排尽装置中的空气,否则SnCl4在空气中极易水解生成SnO2·хH2O,发生的副反应是SnCl4+(x+2)H2O=SnO2·xH2O↓+4HCl↑,防止Sn 在加热时被空气中氧气氧化,发生的副反应为:Sn+O2![]() SnO2;(3)SnCl4在湿空气中极易水解生成SnO2·xH2O,通过试剂B防止水蒸气进入收集器,故试剂B为浓硫酸;氯气有毒,试剂C吸收氯气的余气,故试剂C为氢氧化钠溶液;试剂B的作用是防止C溶液的水进入收集器;(4)Cl2 和锡的反应产物有SnCl4和SnCl2,为防止产品中带入 SnCl2,可采取的措施是控制Sn与氯气的反应温度在232℃至650℃之间,SnCl4蒸出而SnCl2残留;以及用过量氯气,使产物SnCl4的比例增大;(5)根据反应I2+Sn2+=2I-+Sn4+可知,SnCl4的含量为
SnO2;(3)SnCl4在湿空气中极易水解生成SnO2·xH2O,通过试剂B防止水蒸气进入收集器,故试剂B为浓硫酸;氯气有毒,试剂C吸收氯气的余气,故试剂C为氢氧化钠溶液;试剂B的作用是防止C溶液的水进入收集器;(4)Cl2 和锡的反应产物有SnCl4和SnCl2,为防止产品中带入 SnCl2,可采取的措施是控制Sn与氯气的反应温度在232℃至650℃之间,SnCl4蒸出而SnCl2残留;以及用过量氯气,使产物SnCl4的比例增大;(5)根据反应I2+Sn2+=2I-+Sn4+可知,SnCl4的含量为![]() ×100%=
×100%=![]() 。
。


科目:高中化学 来源: 题型:
【题目】如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是
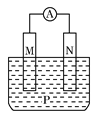
M | N | P | |
A | Zn | Cu | 稀H2SO4溶液 |
B | Cu | Fe | 稀HCl溶液 |
C | Ag | Zn | AgNO3溶液 |
D | Zn | Fe | Fe(NO3)3溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s) ![]() cC(g)+dD(g),在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )
cC(g)+dD(g),在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( ) 
A.温度降低,化学平衡向逆反应方向移动
B.使用催化剂,C的物质的量分数增加
C.化学方程式系数a<c+d
D.平衡时再加入A,平衡向右移动,A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极.X,Y,Z三种金属的活动性顺序为( )
A.X>Y>Z
B.X>Z>Y
C.Y>X>Z
D.Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明可逆反应N2(g)+3H2(g)![]() 2NH3(g)已达到平衡状态的是( )
2NH3(g)已达到平衡状态的是( )
①6个N—H键形成的同时,有3个H—H键断裂;②3个H—H键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3、N2、H2的体积分数都不再改变;⑥恒温恒容时,密度保持不变;⑦3v(N2)正 =v(H2)逆;⑧容器内A、B、C、D四者共存 ⑨NH3的生成速率与分解速率相等; ⑩A 、B、C的分子数目比为1:3:2。
A. 全部 B. ①③④⑤⑧ C. ②③④⑤⑦⑨ D. ①③⑤⑥⑦⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一固定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 ![]() 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2 , 气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题(计算结果保留一位小数):
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2 , 气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题(计算结果保留一位小数):
(1)判断该反应达到平衡状态的标志是。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.向装置中再充入SO3
(3)求该反应达到平衡时SO2的转化率为(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的Ba(OH)2溶液,生成沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把100mL 2mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率而不影响生成H2的总量,可在反应物中加入适量的( )
A.硫酸铜溶液
B.硝酸钠溶液
C.醋酸钠溶液
D.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL H2SO4与CuSO4的混合液中,用石墨作电极电解,两极上均收集到2.24L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
A.0.5 mol/L
B.1 mol/L
C.3 mol/L
D.4 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com