
【题目】在100mL H2SO4与CuSO4的混合液中,用石墨作电极电解,两极上均收集到2.24L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
A.0.5 mol/L
B.1 mol/L
C.3 mol/L
D.4 mol/L
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】根据热化学方程式:S(l)+O2(g)![]() SO2(g)△H= -293.23kJ/mol,分析下列说法正确的是( )
SO2(g)△H= -293.23kJ/mol,分析下列说法正确的是( )
A. S(s)+O2(g)![]() SO2(g),反应放出的热量大于293.23kJ/mol
SO2(g),反应放出的热量大于293.23kJ/mol
B. S(s)+O2(g)![]() SO2(g),反应放出的热量小于293.23kJ/mol
SO2(g),反应放出的热量小于293.23kJ/mol
C. 1molSO2(g)的化学键断裂吸收的能量总和大于1molS(l)和1molO2(g)的化学键断裂吸收的能量之和。
D. 1molSO2(g)的化学键断裂吸收的能量总和小于1molS(l)和1molO2(g)的化学键断裂吸收的能量之和。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如图所示。回答下列问题:
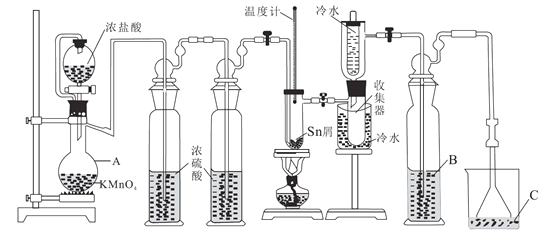
已知:①SnCl4在空气中极易水解生成SnO2·хH2O
②
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
(1)仪器A的名称是_______,其中发生反应的离子方程式是____________。
(2)点燃酒精灯前需排尽装置中的空气,否则会发生副反应,化学方程式是______、_____。
(3)试剂 B、C依次为_______,试剂B的作用是______。
(4)Cl2 和锡的反应产物有SnCl4和SnCl2,为防止产品中带入 SnCl2,可采取的措施是_______、_______。
(5)碘氧化法滴定分析产品中2价Sn(II)的含量。准确称取m g产品于锥形瓶中,用蒸馏水溶解,淀粉-KI溶液做指示剂,用c mol·L-1 碘标准溶液滴定至终点,消耗碘标准溶液V mL,计算产品中Sn(II)的含量_______(用含c、m、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,与对应的叙述相符的是
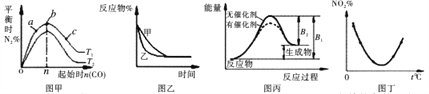
A. 图甲表示反应:4CO(g) +2NO2(g)==N2(g) +4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1<T2,b点处NO2的转化率最大
B. 图乙表示某条件对2A(g) +B(g)==3C(g)的影响,乙一定使用了催化剂
C. 图丙表示的某可逆反应是吸热反应,该图表明催化剂能同时改变正逆反应的活化能
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH>0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述是可逆反应N2(g)+3H2(g) ![]() 2NH3(g),在定容密闭容器中达到平衡的标志的是( )
2NH3(g),在定容密闭容器中达到平衡的标志的是( )
①NH3的生成速率与NH3的分解速率相等;
②单位时间内amolN2生成,同时生成3a mol H2 ;
③N2的浓度不再变化;
④混合气体的总压强不再变化;
⑤混合气体的平均摩尔质量不再变化;
⑥用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑦ N2、H2、NH3的分子数目比为1:3:2;
⑧混合气体的密度不再变化。
A.②⑤
B.①③④⑤
C.②⑥⑦⑧
D.⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图。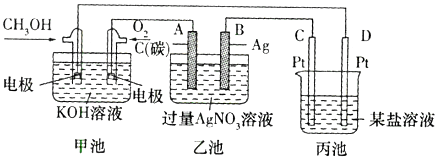
(1)图中丙池是装置(填“电解池”或“原电池”),甲池中K+移向极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式:。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为极(填“A”或“B")。
(4)乙池中总反应的离子方程式。
(5)当乙池中B(Ag)极的质量增加5.40 g时,乙池的pH是(若此时乙池中溶液的体积为500 mL);通过导线的电量是(结果保留3位有效数字,已知:NA =6.02×1023 , 电子的电量为1.60 ×10-19);此时丙池某电极析出1.60 g某金属,则丙中的某盐溶液可能是
A.MgSO4 B.CuSO4
C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
A. 标准状况下,5.6LHF中含有电子数为2.5NA
B. 50g质量分数为46%的乙醇溶液中,氢原子的总数为3NA
C. 1 molNa2O2固体中含阴离子总数为2NA
D. 0.1 molH2和0.1 mol I2 于密闭容器中充分反应,其分子总数为 0.2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com