
【题目】对氨基苯甲酸酯类是一类局部麻醉药,化合物M是该类药物之一。合成M的一种路线如下:

已知以下信息:
①核磁共振氢谱显示B只有一种化学环境的氢,H苯环上有两种化学环境的氢。
② 。
。
③E为芳香烃,其相对分子质量为92。
④![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)A的结构简式为_________________,其化学名称是_____________________。
(2)由E生成F的化学方程式为_________________________________________。
(3)由G生成H的反应类型为__________________,H在一定条件下可以发生聚合反应,写出该聚合反应的化学方程式__________________________________________________。
(4)M的结构简式为________________________________。
(5)D的同分异构体中不能与金属钠反应生成氢气的共有_________种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6:1的是_________________(写结构简式)。
(6)参照上述合成路线,以乙烯和环氧乙烷为原料(无机试剂任选)制备1,6-己二醛,设计合成路线 ___________________________________________________________________。
【答案】 ![]() 2—甲基丙烯
2—甲基丙烯 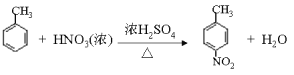 还原反应 n
还原反应 n ![]()
![]()
![]() +(n—1)H2O
+(n—1)H2O 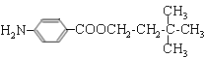 15
15 ![]()
【解析】A与溴化氢发生加成反应生成B,磁共振氢谱显示B只有一种化学环境的氢,则B的结构简式为CBr(CH3)3,则A的结构简式为CH2=C(CH3)2。根据已知信息②可知C与环氧乙烷反应生成D,则D的结构简式为(CH3)3CCH2CH2OH。E为芳香烃,其相对分子质量为92,则E是甲苯,甲苯发生硝化反应生成F,由于H苯环上有两种化学环境的氢,这说明硝基在甲基的对位,即F的结构简式为![]() 。由于氨基易被氧化,所以F生成G是甲基的氧化反应,引入羧基,即G的结构简式为
。由于氨基易被氧化,所以F生成G是甲基的氧化反应,引入羧基,即G的结构简式为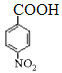 。G中的硝基被还原转化为氨基,则H的结构简式为
。G中的硝基被还原转化为氨基,则H的结构简式为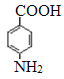 。H和D发生酯化反应生成M,则M的结构简式为
。H和D发生酯化反应生成M,则M的结构简式为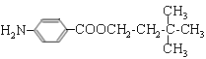 。
。
(1)根据以上分析可知A的结构简式为![]() ,其化学名称是 2-甲基丙烯。(2)由E生成F的化学方程式为
,其化学名称是 2-甲基丙烯。(2)由E生成F的化学方程式为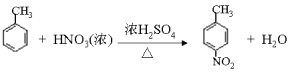 。(3)由G生成H的反应类型为还原反应,H分子中含有羧基和氨基,在一定条件下可以发生聚合反应,该聚合反应的化学方程式 n
。(3)由G生成H的反应类型为还原反应,H分子中含有羧基和氨基,在一定条件下可以发生聚合反应,该聚合反应的化学方程式 n![]()
![]()
![]() +(n—1)H2O。(4)M的结构简式为
+(n—1)H2O。(4)M的结构简式为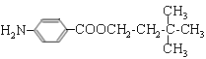 。(5)D的同分异构体中不能与金属钠反应生成氢气,说明含有醚键,可以是甲醇和戊醇形成,戊基有8种,相应醚有8种;可以是乙醇和丁醇形成,丁醇有4种,相应醚有4种;可以是2分子丙醇形成,丙醇有2种,相应的醚类有3种,共计15种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6:1的是
。(5)D的同分异构体中不能与金属钠反应生成氢气,说明含有醚键,可以是甲醇和戊醇形成,戊基有8种,相应醚有8种;可以是乙醇和丁醇形成,丁醇有4种,相应醚有4种;可以是2分子丙醇形成,丙醇有2种,相应的醚类有3种,共计15种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6:1的是![]() 。(6)参照上述合成路线和题干信息可知以乙烯和环氧乙烷为原料(无机试剂任选)制备1,6-己二醛的合成路线为
。(6)参照上述合成路线和题干信息可知以乙烯和环氧乙烷为原料(无机试剂任选)制备1,6-己二醛的合成路线为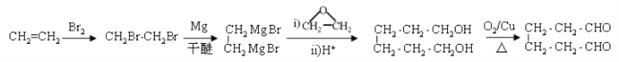 。
。


 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是
A.现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3∶2∶1
B.n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为![]()
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.5.6 g CO和22.4 L CO2中含有的碳原子数一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是( )
A. 1s22s22p63s23p2→1s22s22p63s23p1
B. 1s22s22p63s23p3→1s22s22p63s23p2
C. 1s22s22p63s23p4→1s22s22p63s23p3
D. 1s22s22p63s23p63d104s24p1→1s22s22p63s23p63d104s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是

A.分子中两个苯环一定处于同一平面
B.不能与饱和Na2CO3溶液反应
C.在酸性条件下水解,水解产物只有一种
D.1 mol化合物X最多能与2 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1) ______mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(2)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为______。
(3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为______。
(4)标准状况下,密度为0.75 g·L1的NH3与CH4组成的混合气体中,NH3的体积分数为______,该混合气体对氢气的相对密度为______。
(5)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将a g该结晶水合物加热至结晶水全部失去,剩余的残渣为b g,则n=______。
(6)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和钠可形成化合物Na3N,它能与水剧烈反应产生NH3,下列叙述正确的是:( )
A. Na3N与水的反应是氧化还原反应
B. Na3N 是共价化合物
C. Na3N中4个离子均满足最外层8电子稳定结构
D. Na3N中钠离子半径大于氮离子半径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题。
族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)O和S中,原子半径较大的是________;(填元素符号或化学,以下同)
(2)CH4和NH3中,热稳定性较强的是________;
(3)新制氯水有漂白作用,是因为其中含有________;
(4)元素最高价氧化物对应水化物中,碱性最强的是________,存放该溶液的试剂瓶盖不能用玻璃塞,请写出该反应的离子方程式_____________________________________;元素最高价氧化物对应水化物中,两性氢氧化物是__________;
(5)为了除去甲烷混有的少量乙烯可用________试剂;
(6)乙酸与乙醇在一定条件下可制备具有特殊香味的物质,请写出该反应的化学方程式____________________;试验中用到了饱和碳酸钠溶液,其作用有____________________。
(7) 在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解乙二醛制备乙二酸(HOOC-COOH)的装置如图所示,通电后,Pt2电极上产生的氯气将乙二醛氧化为乙二酸,下列说法正确的是

A. Pt2接电源的负极,发生还原反应
B. 盐酸的作用是提供Cl-和增强导电性
C. 电路上每转移1mol电子产生45g乙二酸
D. Pt1极上的电极反应为:2H2O-4e-=== O2↑ + 4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com