
【题目】填写下列空白:
(1) ______mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(2)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为______。
(3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为______。
(4)标准状况下,密度为0.75 g·L1的NH3与CH4组成的混合气体中,NH3的体积分数为______,该混合气体对氢气的相对密度为______。
(5)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将a g该结晶水合物加热至结晶水全部失去,剩余的残渣为b g,则n=______。
(6)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为______。
【答案】(1)3(1分)
(2)17∶16(1分)
(3)4∶3(1分)
(4)80%(2分) 8.4(2分)
(5)![]() (3分)
(3分)
(6)5(a+bd) g·mol1(3分)
【解析】(4)![]() =0.75 g·L1×22.4 L·mol1=16.8 g·mol1。设NH3的物质的量为x,CH4的物质的量为y,则
=0.75 g·L1×22.4 L·mol1=16.8 g·mol1。设NH3的物质的量为x,CH4的物质的量为y,则![]() =16.8 g·mol1,x∶y=4∶1,NH3的体积分数为
=16.8 g·mol1,x∶y=4∶1,NH3的体积分数为![]() ×100%=80%,该混合气体对H2的相对密度为
×100%=80%,该混合气体对H2的相对密度为![]() =8.4。
=8.4。
(5)A·nH2O![]() A+nH2O
A+nH2O
M+18n M
a g b g
(M+18n)∶M=a∶b,解得n=![]() 。
。
(6)依据质量守恒定律有a g+b g=0.2 mol·M(C)+d g,解得M(C)=5(a+bd) g·mol1。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述符合的是

A. 用甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B. 图乙表示反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0的平衡常数K与温度和压强的关系
2SO3(g)△H<0的平衡常数K与温度和压强的关系
C. 图丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中![]() 随HCl溶液体积变化关系
随HCl溶液体积变化关系
D. 图丁表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按照电解质、非电解质、弱电解质顺序排列的是
A. 冰水混合物 干冰 冰醋酸 B. 硫酸 乙醇 氨水
C. 盐酸 SO2 乙酸 D. 氯化钠固体 液氯 BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的部分表示圆圈内的物质相互反应,已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。下列说法正确的是
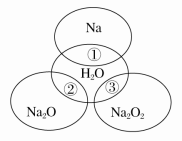
A.反应③最多能产生0.05 mol O2
B.反应①的离子方程式为Na+2H2O==Na++2OH-+H2↑
C.Na2O2中阴阳离子数目之比为1∶1
D.①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基苯甲酸酯类是一类局部麻醉药,化合物M是该类药物之一。合成M的一种路线如下:

已知以下信息:
①核磁共振氢谱显示B只有一种化学环境的氢,H苯环上有两种化学环境的氢。
② 。
。
③E为芳香烃,其相对分子质量为92。
④![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)A的结构简式为_________________,其化学名称是_____________________。
(2)由E生成F的化学方程式为_________________________________________。
(3)由G生成H的反应类型为__________________,H在一定条件下可以发生聚合反应,写出该聚合反应的化学方程式__________________________________________________。
(4)M的结构简式为________________________________。
(5)D的同分异构体中不能与金属钠反应生成氢气的共有_________种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6:1的是_________________(写结构简式)。
(6)参照上述合成路线,以乙烯和环氧乙烷为原料(无机试剂任选)制备1,6-己二醛,设计合成路线 ___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铁盐或其氧化物在生产生活和科学实验中应用广泛。
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0kJ/mol
①反应Fe2O3(s)+3 CH4(g)![]() 2Fe(s)+3CO(g) +6H2(g)的△H______0(填“>”、“<”或“=”)
2Fe(s)+3CO(g) +6H2(g)的△H______0(填“>”、“<”或“=”)
②若该反应在5L的密闭容器中进行,1min后达到平衡,测得体系中固体质量减少0.96g。则该段时间内CO的平均反应速率为__________。
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是______(选填序号)
a.c(CH4)=c(CO)
b.固体的总质量不变
c.v(CO)与v(H2)的比值不变
d.混合气体的平均相对分子质量不变
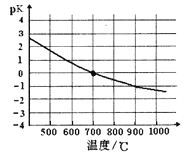
④该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如下图。试用平衡移动原理解释该曲线的变化规律:______________________。若700℃时测得c平衡(H2)=1.0mol·L-1,则CH4的转化率为_________。
(2)菱铁矿的主要成分是:FeCO3,实验室中可以通过FeSO4与NaHCO3溶液混合制得FeCO3,有关反应的离子方程式为:____________________。已知Ksp[FeCO3]=3.2×10-11,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11。试通过以上数据简要计算说明该反应能进行的原因_____________________。
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备, 写出阳极电极反应式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E各物质的关系如下图所示:

已知:X能使湿润的红色石蕊试纸变蓝。
(1)无色液体A是_____,A与B反应的化学方程式是____________。
(2)由X转化为N2的化学方程式为______________。
(3)白色固体C的化学式为 _____。由D转化为E的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 石油裂解可制取乙烯、丙烯 B. 以淀粉为原料可制取乙酸乙酯
C. 植物油氢化过程中发生了加成反应 D. 煤经过气化和液化等物理变化可以转化为清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某CH4和CO组成的混合气体与氢气的密度比为12.5,现有该混合气体33.6L(标准状况条件下)在氧气中充分燃烧,将所得气体通过装有足量的浓硫酸的试剂瓶,求试剂瓶增重____________克。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com