
| 沉淀物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Cd(OH)2 | Mn(OH)2 | pH值 | 8.0 | 9.7 | 3.2 | 6.7 | 9.4 | 10.4 |


科目:高中化学 来源: 题型:阅读理解
 三聚氰胺(结构简式如右)由于含氮量高而常被不法商人用作食品添加剂,因此三聚氰胺也被人称为“蛋白精”. 三聚氰胺是一种纯白色晶体,无味,常压熔点354℃(分解);快速加热升华,升华温度300℃.三聚氰胺早期合成使用双氰胺法:由电石(CaC2)在N2氛围中加热可制备氰胺化钙(CaCN2),氰胺化钙水解后二聚生成双氰胺(C2H4N4),再加热即转化为三聚氰胺.与该法相比,尿素法成本低,目前较多采用.尿素以氨气为载体,硅胶为催化剂,在380-400℃温度下沸腾反应生成三聚氰胺:6CO(NH2)2→C3N6H6+6NH3+3CO2.
三聚氰胺(结构简式如右)由于含氮量高而常被不法商人用作食品添加剂,因此三聚氰胺也被人称为“蛋白精”. 三聚氰胺是一种纯白色晶体,无味,常压熔点354℃(分解);快速加热升华,升华温度300℃.三聚氰胺早期合成使用双氰胺法:由电石(CaC2)在N2氛围中加热可制备氰胺化钙(CaCN2),氰胺化钙水解后二聚生成双氰胺(C2H4N4),再加热即转化为三聚氰胺.与该法相比,尿素法成本低,目前较多采用.尿素以氨气为载体,硅胶为催化剂,在380-400℃温度下沸腾反应生成三聚氰胺:6CO(NH2)2→C3N6H6+6NH3+3CO2.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 实验化学
实验化学查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
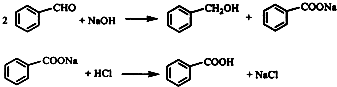
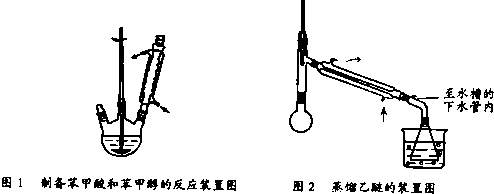


查看答案和解析>>
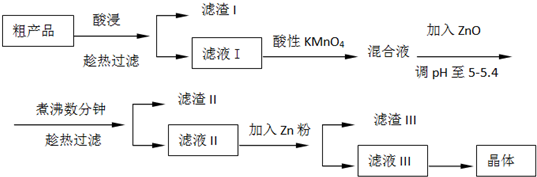
科目:高中化学 来源: 题型:阅读理解
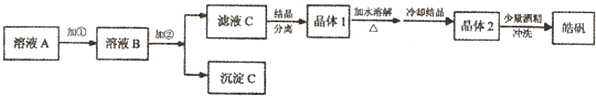
| 温度(℃) | 60 | 240 | 930 | 1000 |
| 残留固体质量(g) | 19.7 | 16.1 | 8.1 | 8.1 |
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com