
【题目】氨和甲烷等原料在工业生产中发挥着重要的作用。
Ⅰ.我国科学家以MoS2 为催化剂,通过调节催化剂/电解质的表界面相互作用,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图所示。
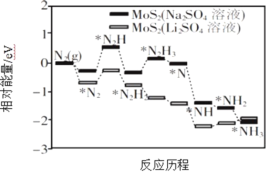
(1)将Na2SO4 溶液换成Li2SO4 溶液后,反应速率明显加快的主要原因是加快了下列____________转化的反应速率(填标号)。
A.N2→*N2 B.*N2→*N2H C.*N2H3→*N D.*NH→*NH2
Ⅱ. 甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(2)已知:CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH1=akJ·mol—1,
2CO(g)+O2(g)= 2CO2(g) ΔH2=b kJ·mol—1,
2H2(g) +O2(g)=2 H2O (l) ΔH3=c kJ·mol—1
CO(g)+ H2O(g)= CO2(g)+ H2 (g) ΔH4=d kJ·mol—1
则甲烷水蒸气重整反应的ΔH=____________kJ·mol—1(用字母a、b、c、d表示)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2物质的量分数与水碳比、平衡温度的关系如图所示:
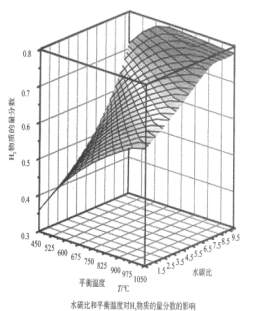
①结合如图回答:当平衡温度一定时,H2的物质的量分数与水碳比(1~10)的关系是________,其原因是_____________。
②若密闭容器中仅发生CH4(g)+H2O(g)![]() CO(g)+3H2(g),平衡温度为750℃,水碳比为1.0时,H2的物质的量分数0.5,甲烷的转化率为___________,其压强平衡常数Kp为________;用气体分压表示反应速率方程为v=k p(CH4)·p—1(H2),则此时反应速率v=_________。(已知:气体分压=气体的物质的量分数×总压,速率方程中k 为速率常数)。
CO(g)+3H2(g),平衡温度为750℃,水碳比为1.0时,H2的物质的量分数0.5,甲烷的转化率为___________,其压强平衡常数Kp为________;用气体分压表示反应速率方程为v=k p(CH4)·p—1(H2),则此时反应速率v=_________。(已知:气体分压=气体的物质的量分数×总压,速率方程中k 为速率常数)。
Ⅲ.利用天然气合成氨,并生产尿素的流程如下:
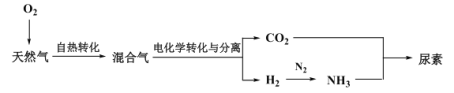
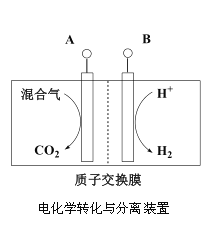
(3)“电化学转化与分离”装置如图,混合气中CO转化成CO2的电极反应式为______。
【答案】B (a+d-b-c) 水碳水比大时,H2的物质的量分数越大 水碳水比较大时,CO会与H2O进一步反应生成H2,使H2的物质的量分数增大 50.0% 7.5×10-3(MPa) ![]() CO-2e-+H2O=CO2+2H+
CO-2e-+H2O=CO2+2H+
【解析】
(1)由图可知,![]() 需要吸收的能量最高,是该反应过程中的决定反应速率的步骤,将Na2SO4 溶液换成Li2SO4 溶液后,
需要吸收的能量最高,是该反应过程中的决定反应速率的步骤,将Na2SO4 溶液换成Li2SO4 溶液后,![]() 需要的能量降低,反应速率加快,故选B;
需要的能量降低,反应速率加快,故选B;
(2)设CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH1=akJ·mol—1,为反应①;
2CO(g)+O2(g)= 2CO2(g) ΔH2=b kJ·mol—1,为反应②;
2H2(g) +O2(g)=2 H2O (l) ΔH3=c kJ·mol—1,为反应③;
CO(g)+ H2O(g)= CO2(g)+ H2 (g) ΔH4=d kJ·mol—1为反应④;
根据盖斯定律,反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)可由①+④-②-③得到,故该反应的ΔH= (a+d-b-c) kJ·mol—1;
CO(g)+3H2(g)可由①+④-②-③得到,故该反应的ΔH= (a+d-b-c) kJ·mol—1;
①根据曲线走势可知,水碳比越大,H2的物质的量分数越大;根据题(2)中的反应可知,当水碳比较大时,甲烷水解重整反应体系中会存在CO与H2O的反应CO(g)+ H2O(g)= CO2(g)+ H2 (g),会使H2的物质的量分数增大;
②由于水碳比为1.0,设开始加入的CH4和H2O的物质的量都为![]() ,转化的物质的量为
,转化的物质的量为![]() 。
。
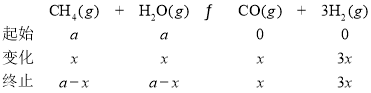
![]() ,解得
,解得![]() =0.5
=0.5![]() mol,故CH4的转化率为
mol,故CH4的转化率为![]() ;
;
反应后的总物质的量为3![]() mol,所以CH4、H2O、CO、H2的分压分别为:
mol,所以CH4、H2O、CO、H2的分压分别为:![]() 、
、![]() 、
、![]() 、
、![]() ,
,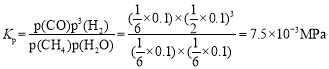 ;
;
用气体分压表示反应速率方程为v=k p(CH4)·p—1(H2)=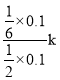 =
= ![]() ;
;
(3)CO转化成CO2时CO失电子,电极反应为:CO-2e-+H2O=CO2+2H+。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向苯酚钠溶液中通入少量CO2:2C6H5O![]() +CO2+H2O→2C6H5OH+CO32-
+CO2+H2O→2C6H5OH+CO32-
B. NH4HSO3溶液与足量NaOH溶液反应:HSO![]() +OH-=SO32-+H2O
+OH-=SO32-+H2O
C. Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+=Fe2++2H2O
D. H218O2中加入H2SO4酸化的KMnO4:5H218O2+2MnO![]() +6H+= 518O2+2Mn2++8H2O
+6H+= 518O2+2Mn2++8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置、操作正确,且能实现相应实验目的的是:
实验装置 | 实验操作 | 实验目的 | |
A |
| 用标准KMNO4溶液滴定Na2S2O3溶液 | 测定Na2S2O3溶液浓度 |
B |
| 蒸发AlCl3溶液 | 得到AlCl3固体 |
C |
| 逐滴滴加 AgNO3 溶液 | 根据沉淀产生的先后顺序确定Ksp(A gCl)和Ksp(AgI)的大小 |
D |
| 加热 NH4Cl 固体 | 制备 NH3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018 年 11 月《Nature Energy》报道了中科院大连化学物理研究所科学家用 Ni-BaH2/Al2O3、Ni-LiH 等作催化剂,实现了在常压、100~300℃的条件下合成氨。
(1)在元素周期表中,Li、O、H 三种元素的电负性由大到小的顺序为___________;Al 原子核外电子空间运动状态有 8 种,则该原子处于____(填“基态”或“激发态”)。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为 182℃,沸点为 233℃。
①硝酸溶液中 NO3的空间构型为__________ 。
②甘氨酸中 N 原子的杂化类型为 ________,分子中σ键与π键的个数比为_________;其熔点、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为 141℃)的主要原因:一是甘氨酸能形成内盐,二是______________。
(3)[Cu(NH3)4]2+在实验室中制备方法如下:向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出蓝色沉淀溶解得到深蓝色溶液的离子方程式___________________。
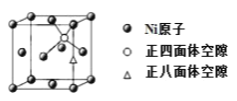
(4)X-射线衍射分析表明,由 Ni 元素形成的化合物 Mg2NiH4 的立方晶胞如图所示,其面心和顶点均被 Ni 原子占据,所有 Mg 原子的 Ni 配位数都相等。则 Mg 原子填入由 Ni 原子形成的 ___空隙中(填“正四面体”或“正八面体”),填隙率是____。
(5)已知 Mg2NiH4 晶体的晶胞参数为 646.5 pm,液氢的密度为0.0708 gcm-3。若以材料中氢的密度与液氢密度之比定义为储氢材料的储氢能力,在 Mg2NiH4 的储氢能力为____________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lg X=lg![]() 或lg
或lg![]() ,下列叙述正确的是
,下列叙述正确的是

A.25 ℃时,CO32-+H2O![]() HCO3-+OH-的平衡常数为1.0×10-7.6
HCO3-+OH-的平衡常数为1.0×10-7.6
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.曲线m表示pH与 -lg![]() 的变化关系
的变化关系
D.Ka1(H2CO3)的数量级为10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:2H2(g)+CO(g) ![]() CH3OH(g);ΔH=-90.8kJ/mol。
CH3OH(g);ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K=____,如升高温度,K值将______(填:增大、减小或不变)。
(2)以下各项能说明该反应达到平衡状态的是____________.
A.混合气体的密度保持不变 B.甲醇的质量分数保持不变
C.CO的浓度保持不变 D.2v逆(H2)=v正(CH3OH)
(3)在210°C、240°C和270°C三种不同温度、2 L恒容密闭容器中研究合成甲醇的规律。
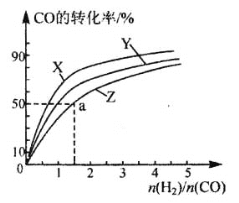
如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是_____。由起始达到a点所需时间为5min,则H2的反应速率为:_______________mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。
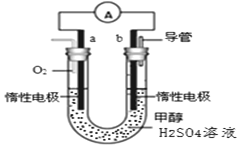
①该电池工作时,正极是____________极(填“a”或 “b”);
②该电池负极反应的离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用如图所示装置,对浓硝酸与木炭的反应进行探究(已知:4HNO3![]() 4NO2↑+O2↑+2H2O)。
4NO2↑+O2↑+2H2O)。
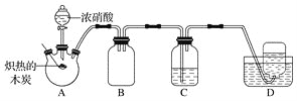
请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至炽热状态,伸入三颈烧瓶中,生成的气体的颜色为__,产生该气体的反应的化学方程式是__。
(2)装置C中盛有足量Ba(OH)2溶液,炽热的木炭与浓硝酸反应后可观察到C中出现白色沉淀,该白色沉淀为__(填化学式)。
(3)装置B的作用是__。
(4)装置D中收集到了无色气体,有同学认为是NO,还有同学认为是O2。
①下列对该气体的检验方法合适的是__(填字母)。
A.敞口观察装置D中集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果D中集气瓶内收集到的无色气体是氧气,则氧气的来源是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温电解H2OCO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )

A.X是电源的负极
B.阴、阳两极生成的气体的物质的量之比是1∶1
C.总反应可表示为H2O+CO2![]() H2+CO+O2
H2+CO+O2
D.阴极的电极反应式是H2O+2e-=H2+O2-、CO2+2e-=CO+O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学能与其他能量相互转化的说法正确的是( )
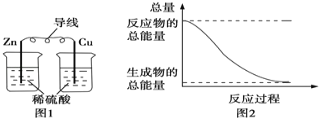
A. 图1所示的装置能将化学能转变为电能
B. 图2所示的反应为吸热反应
C. 中和反应中,反应物的总能量比生成物的总能量低
D. 化学反应中能量变化的主要原因是化学键的断裂与形成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com