
【题目】25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lg X=lg![]() 或lg
或lg![]() ,下列叙述正确的是
,下列叙述正确的是

A.25 ℃时,CO32-+H2O![]() HCO3-+OH-的平衡常数为1.0×10-7.6
HCO3-+OH-的平衡常数为1.0×10-7.6
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.曲线m表示pH与 -lg![]() 的变化关系
的变化关系
D.Ka1(H2CO3)的数量级为10-7
【答案】D
【解析】
H2CO3的Ka1=![]() 、Ka2=
、Ka2=![]() ,Ka1Ka2,当c(H+)相同时,
,Ka1Ka2,当c(H+)相同时,![]()
![]() ,根据图像知,n曲线代表pH与-lg
,根据图像知,n曲线代表pH与-lg![]() 的变化关系,m曲线代表pH与-lg
的变化关系,m曲线代表pH与-lg![]() 的变化关系;据此分析作答。
的变化关系;据此分析作答。
A.H2CO3的电离平衡常Ka2=![]() ,在M点,-lg
,在M点,-lg![]() =1,则
=1,则![]() =10-1,pH=9.3,c(H+)=10-9.3 mol/L,则Ka2=10-10.3,25 ℃时,CO32-+H2O
=10-1,pH=9.3,c(H+)=10-9.3 mol/L,则Ka2=10-10.3,25 ℃时,CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=
HCO3-+OH-的平衡常数Kh=![]() ,A错误;
,A错误;
B.溶液中电荷守恒为:c(Na+) +c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(Cl-),溶液呈中性时,c(H+)=c(OH-),则c(Na+)=c(HCO3-)+2c(CO32-)+c(Cl-),B错误;
C.H2CO3的Ka1=![]() 、Ka2=
、Ka2=![]() ,Ka1Ka2,当c(H+)相同时,
,Ka1Ka2,当c(H+)相同时,![]()
![]() ,根据图像知,n曲线代表pH与-lg
,根据图像知,n曲线代表pH与-lg![]() 的变化关系,m曲线代表pH与-lg
的变化关系,m曲线代表pH与-lg![]() 的变化关系,C错误;
的变化关系,C错误;
D.H2CO3的Ka1=![]() ,在N点,-lg
,在N点,-lg![]() =-1,则
=-1,则![]() =10,pH=7.4,c(H+)=10-7.4 mol/L,Ka1=10-6.4,Ka1(H2CO3)的数量级为10-7,D正确;
=10,pH=7.4,c(H+)=10-7.4 mol/L,Ka1=10-6.4,Ka1(H2CO3)的数量级为10-7,D正确;
故选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
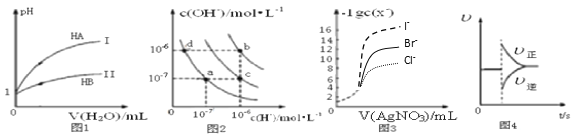
A. 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
B. 图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
C. 用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
D. 图4表示在N2(g)+3H2(g) ![]() 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3—CH=CH2+HBr→CH3—CHBr—CH3(主要产物),1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下面所示的一系列变化。
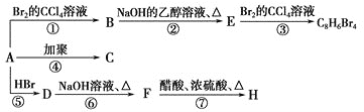
(1)A的化学式:________,A的结构简式________。
(2)上述反应中,①是________反应,⑦是________反应。(填反应类型)
(3)写出C,D,E,H物质的结构简式:
C_________,D_________,E_______,H________。
(4)写出DF反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是白色菱形结晶体,毒性较低,对环境污染污染程度低,可作新型水处理剂和金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的 MoS2)制备钼酸钠的两种途径如图所示。
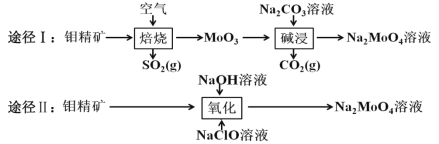
(1)途径Ⅰ焙烧过程中,为了提高焙烧效率,除增大空气量外还可以采用的措施有___; 在该过程的主要反应中,氧化剂与还原剂物质的量之比为________。
(2)途径Ⅱ氧化时还有 Na2SO4 生成,则反应的离子方程式为 ____________。
(3)已知途径Ⅰ的钼酸钠溶液中 c(MoO42-)=0.40 molL-1,c(CO32-)=0.10 molL-1。由钼酸钠溶液制备钼酸钠晶体时,需加入 Ba(OH)2 固体以除去 CO32-。在不损失 MoO42-的情况下,CO32-的最大去除率是 ____________ [已知 Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。
(4)途径Ⅱ中 Na2MoO4 溶液通过结晶的方法可得到 Na2MoO4 晶体。母液可以循环利用,但循环一定次数后必须对母液进行处理,试解释原因 _________。
(5)途径Ⅱ比途径Ⅰ的优点有 ________________(答出两条)。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图。
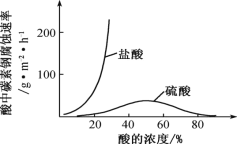
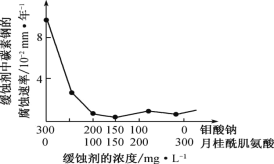
①当硫酸的浓度大于 90%时,碳素钢腐蚀速率几乎为零,原因是________________。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为 300 mgL-1,则缓蚀效果最好时钼酸钠(M=206 gmol-1)的物质的量浓度为 ________(计算结果保留 3 位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和甲烷等原料在工业生产中发挥着重要的作用。
Ⅰ.我国科学家以MoS2 为催化剂,通过调节催化剂/电解质的表界面相互作用,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图所示。
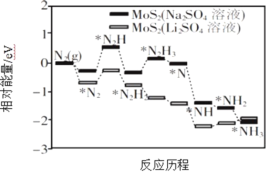
(1)将Na2SO4 溶液换成Li2SO4 溶液后,反应速率明显加快的主要原因是加快了下列____________转化的反应速率(填标号)。
A.N2→*N2 B.*N2→*N2H C.*N2H3→*N D.*NH→*NH2
Ⅱ. 甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(2)已知:CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH1=akJ·mol—1,
2CO(g)+O2(g)= 2CO2(g) ΔH2=b kJ·mol—1,
2H2(g) +O2(g)=2 H2O (l) ΔH3=c kJ·mol—1
CO(g)+ H2O(g)= CO2(g)+ H2 (g) ΔH4=d kJ·mol—1
则甲烷水蒸气重整反应的ΔH=____________kJ·mol—1(用字母a、b、c、d表示)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2物质的量分数与水碳比、平衡温度的关系如图所示:
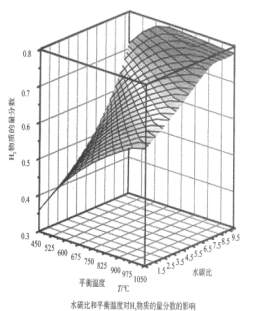
①结合如图回答:当平衡温度一定时,H2的物质的量分数与水碳比(1~10)的关系是________,其原因是_____________。
②若密闭容器中仅发生CH4(g)+H2O(g)![]() CO(g)+3H2(g),平衡温度为750℃,水碳比为1.0时,H2的物质的量分数0.5,甲烷的转化率为___________,其压强平衡常数Kp为________;用气体分压表示反应速率方程为v=k p(CH4)·p—1(H2),则此时反应速率v=_________。(已知:气体分压=气体的物质的量分数×总压,速率方程中k 为速率常数)。
CO(g)+3H2(g),平衡温度为750℃,水碳比为1.0时,H2的物质的量分数0.5,甲烷的转化率为___________,其压强平衡常数Kp为________;用气体分压表示反应速率方程为v=k p(CH4)·p—1(H2),则此时反应速率v=_________。(已知:气体分压=气体的物质的量分数×总压,速率方程中k 为速率常数)。
Ⅲ.利用天然气合成氨,并生产尿素的流程如下:
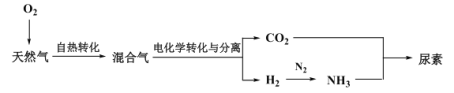
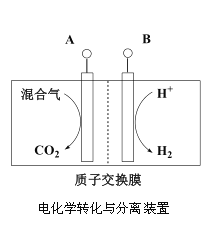
(3)“电化学转化与分离”装置如图,混合气中CO转化成CO2的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米氧化锌是一种多功能性的新型无机材料,在橡胶、玻璃、涂料等各个领域广泛的应用。工业由粗氧化锌(含少量FeO、CuO 等杂质) 制备活性氧化锌的工业流程如下:

已知:Fe3+、Fe2+、Cu2+完全沉淀的pH分别是:3.2,8.1,6.7
(1)“酸浸”时用的硫酸溶液的密度为1.4g/mL,质量分数为70%,则该硫酸的物质的量浓度为____。
(2)焙烧前粉碎的目的是____________________________________________。
(3)滤液中加锌粉的目的是_____________________________________。
(4)物质A的主要成分_______________(填化学式),检验A中阳离子的方法是_______________。
(5)滤液中加H2O2发生反应的离子方程式__________________________。
(6)6.82g碱式碳酸锌[aZn(OH)2·bZnCO3·cH2O]恰好溶解在40mL3mol/LHCl中,同时产生448mLCO2(标准状况下),试推算碱式碳酸锌的化学式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种二次锂离子电池工作时反应为:LixCn + Li(1-x)CoO2 == LiCoO2 + nC。电池如图所示。下列说法不正确的是
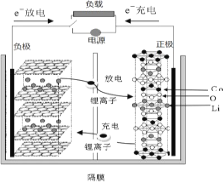
A.放电时,碳材料极失去电子,发生氧化反应,电子经外电路,Li+经内电路同时移向正极
B.放电时正极反应为: Li(1-x)CoO2 + xLi+ + xe- = LiCoO2
C.充电时, Li+从负极脱出,又嵌入正极
D.锂离子二次电池正负极之间充放电时发生传输 Li+的反应,少有副反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,关于离子浓度的说法正确的是( )
A.一定浓度的氨水加水稀释的过程中,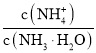 的比值减小
的比值减小
B.浓度均为0.1mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)<c(HCO3-),且3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
C.0.2mol·L-1的醋酸(CH3COOH)溶液与0.1mol·L-1NaOH溶液等体积混合后:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
D.已知浓度均为0.1mol·L-1的NH4Cl、NH3·H2O混合溶液显碱性,则c(NH4+)+2c(H+)=c(NH3·H2O)+2c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com