
����Ŀ����������п��һ�ֶ���Ե����������ϣ�����������Ϳ�ϵȸ�������㷺��Ӧ�á���ҵ�ɴ�����п(������FeO��CuO ������) �Ʊ���������п�Ĺ�ҵ��������:

��֪:Fe3+��Fe2+��Cu2+��ȫ������pH�ֱ���:3.2��8.1��6.7
(1)�������ʱ�õ�������Һ���ܶ�Ϊ1��4g/mL����������Ϊ70%�������������ʵ���Ũ��Ϊ____��
(2)����ǰ�����Ŀ����____________________________________________��
(3)��Һ�м�п�۵�Ŀ����_____________________________________��
(4)����A����Ҫ�ɷ�_______________(�ѧʽ)������A�������ӵķ�����_______________��
(5)��Һ�м�H2O2������Ӧ�����ӷ���ʽ__________________________��
(6)6.82g��ʽ̼��п[aZn(OH)2��bZnCO3��cH2O]ǡ���ܽ���40mL3mol/LHCl�У�ͬʱ����448mLCO2(��״����)���������ʽ̼��п�Ļ�ѧʽΪ___________________________��
���𰸡� 10mol��L-1 ����Ӵ�������ӿ췴Ӧ���� ��ȥ��Һ�к��е�Cu2+���� (NH4)2SO4 ȡ������A��Һ���Թ��У������������Ʋ����ȣ�������ʹʪ��ĺ�ɫʯ����ֽ���������壬����NH4+ 2Fe2++H2O2+2H+=2H2O+2Fe3+ 2Zn(OH)2��ZnCO3��H2O
�����������������(1)����![]() ��������Ũ����(2)�����������Ӵ������ (3)��Һ�к�������ͭ������(4)����Ԫ���غ��������A����Ҫ�ɷ���(5) ������������Һ�к���Fe2+�� H2O2����Fe2+����ΪFe3+��(6)���ݷ�Ӧ����ʽaZn(OH)2��bZnCO3��cH2O+(2a+2b)HCl=��a+b��ZnCl2+bCO2
��������Ũ����(2)�����������Ӵ������ (3)��Һ�к�������ͭ������(4)����Ԫ���غ��������A����Ҫ�ɷ���(5) ������������Һ�к���Fe2+�� H2O2����Fe2+����ΪFe3+��(6)���ݷ�Ӧ����ʽaZn(OH)2��bZnCO3��cH2O+(2a+2b)HCl=��a+b��ZnCl2+bCO2![]() +(2a+b+c)H2O�������ʽ̼��п�Ļ�ѧʽ��
+(2a+b+c)H2O�������ʽ̼��п�Ļ�ѧʽ��
������(1) ![]() =
=![]() mol��L-1 ��(2)�����������Ӵ�������ӿ췴Ӧ������(3)��Һ�к�������ͭ��������п�ۿ��Գ�ȥ��Һ�к��е�Cu2+������(4)����п�۹��˺����Һ�к�������п������̼��������ɼ�ʽ̼��п������Ԫ���غ�������A����Ҫ�ɷ���(NH4)2SO4��ȡ������A��Һ���Թ��У������������Ʋ����ȣ�������ʹʪ��ĺ�ɫʯ����ֽ���������壬����NH4+��(5) ������������Һ�м���H2O2��Fe2+������ΪFe3+����Ӧ���ӷ���ʽ��2Fe2++H2O2+2H+=2H2O+2Fe3+��
mol��L-1 ��(2)�����������Ӵ�������ӿ췴Ӧ������(3)��Һ�к�������ͭ��������п�ۿ��Գ�ȥ��Һ�к��е�Cu2+������(4)����п�۹��˺����Һ�к�������п������̼��������ɼ�ʽ̼��п������Ԫ���غ�������A����Ҫ�ɷ���(NH4)2SO4��ȡ������A��Һ���Թ��У������������Ʋ����ȣ�������ʹʪ��ĺ�ɫʯ����ֽ���������壬����NH4+��(5) ������������Һ�м���H2O2��Fe2+������ΪFe3+����Ӧ���ӷ���ʽ��2Fe2++H2O2+2H+=2H2O+2Fe3+��
(6) 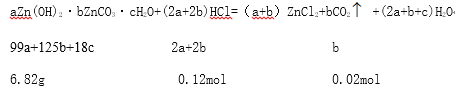
![]() a=2b��
a=2b�� ![]() b=c�����Լ�ʽ̼��п�Ļ�ѧʽ��2Zn(OH)2��ZnCO3��H2O��
b=c�����Լ�ʽ̼��п�Ļ�ѧʽ��2Zn(OH)2��ZnCO3��H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A. ��״���£�11.2 LCH2Cl2�к��з��ӵ���ĿΪ0.5NA
B. ������a gij������CnH2n+2���к��й��õ��Ӷ���ĿΪ![]() ��3n+1��NA
��3n+1��NA
C. 56 g ����ϩ�к���̼̼˫������ĿΪ2NA
D. �����£�0.2 mol/L��FeCl3��Һ�к�Cl����ĿΪ0.6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʫ�䡰���ϵ���˿����������ɻ���ʼ�ɡ��еġ�˿���͡��ᡱ�ֱ�����
A. ��ά�ء�֬�� B. ���ۡ���֬ C. �����ʡ��� D. �����ʡ�ֲ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T���£�����������MSO4 (M: Pb2+��Ba2+��Sr2+)�ij����ܽ�ƽ��������ͼ��ʾ����֪pM=-lgc(M)��p(SO42-)=-lgc(SO42-)������˵����ȷ����
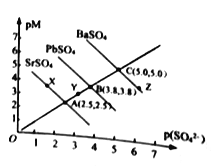
A. �ܶȻ�:BaSO4>PbSO4>SrSO4
B. Y ���SrSO4�Dz�������Һ���ܼ����ܽ�SrSO4
C. Z���Ӧ����Һ��c(Ba2+)42-)�����ߵ�Ũ�Ȼ�����1��10-10
D. BaSO4�� ����ת����PbSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ҫ�ɷֿɱ�ʾΪFeO��Cr2O3��������MgO��Al2O3��Fe2O3�����ʣ��������Ը�����Ϊԭ���Ʊ��ظ���أ�K2Cr2O7��������ͼ��
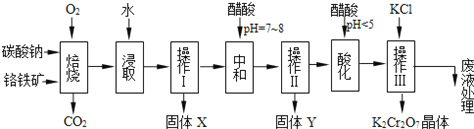
��֪��Na2CO3+Al2O3![]() 2NaAlO2+CO2����
2NaAlO2+CO2����
4FeO��Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2����
8Na2CrO4+2Fe2O3+8CO2����
�ش��������⣺
��1������X����Ҫ����________________����д��ѧʽ����
��2������Y����Ҫ����������������д��������Һ��pH��7��8ʱ�����������������ӷ���ʽ��____________________________________________________________��
��3���ữ��Ŀ����ʹCrO42ת��ΪCr2O72�������������ϡ���ᣬд����ת�������ӷ���ʽ��___________________________________________________________��
��4���������жಽ��ɣ����K2Cr2O7����IJ��������ǣ�����KCl���塢����Ũ����__________�����ˡ�_______�����
��5��������Һ�й���������ʹCr2O72������ɫ�Ĺ���������CrO5���ӽṹΪ![]() �����÷�Ӧ����������Cr2O72�Ĵ��ڡ�д����Ӧ�����ӷ���ʽ��___________________________���÷�Ӧ_________(����ڡ������ڡ�)������ԭ��Ӧ��
�����÷�Ӧ����������Cr2O72�Ĵ��ڡ�д����Ӧ�����ӷ���ʽ��___________________________���÷�Ӧ_________(����ڡ������ڡ�)������ԭ��Ӧ��
��6���ڻ�ѧ�����в���K2CrO4Ϊָʾ������AgNO3����Һ�ζ���Һ�е�Cl������Ag+��CrO42����ש��ɫ������ָʾ����ζ��յ㡣����Һ��Clǡ����ȫ������Ũ�ȵ���1.0��105 mol��L1��ʱ����Һ��c(Ag+)Ϊ_______mol��L1����ʱ��Һ��c(CrO42)����_________mol��L1������֪Ag2CrO4��AgCl��Ksp�ֱ�Ϊ2.0��1012��2.0��1010����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeCl3��Һ�У����������ͭ�ۣ���ַ�Ӧ����Һ��һ�������ڵĽ��������ǣ� ��
A.Fe2+��Cu2+
B.Fe3+
C.Cu2+
D.Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г�����������A��B��C�ͳ�������ס��ҡ���������D��E��F��G��H������֮���ܷ������·�Ӧ��ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ���������

�����������Ϣ�ش� �������⣺
��1��д���������ʵĻ�ѧʽ�� A____B________ F_____ ��______
��2��д�����з�Ӧ���ӷ���ʽ��
��Ӧ��__________________________________________
��Ӧ��_________________________________________
��Ӧ��_________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ������ȷ����
A. ��ϩ�ĵ���ʽΪ�� ![]()
B. �������Ҷ����Ľṹ��ʽΪ�� ![]()
C. ��������Һ��ͨ������CO2�����ӷ���ʽΪ��![]() +H2O+CO2
+H2O+CO2![]()
![]() +HCO3��
+HCO3��
D. ��ȩ��������������Һ��Ӧ�Ļ�ѧ����ʽΪ��HCHO+2Ag(NH3)2OH ![]() HCOONH4+2Ag��+3NH3+H2O
HCOONH4+2Ag��+3NH3+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը�����[��Ҫ�ɷ�ΪFe(CrO2)2��������Al2O3��Fe2O3��SiO2������]Ϊ��Ҫԭ�������ظ����ƾ���(Na2Cr2O7��2H2O��Na2Cr2O7��һ��ǿ������)����Ҫ��������������
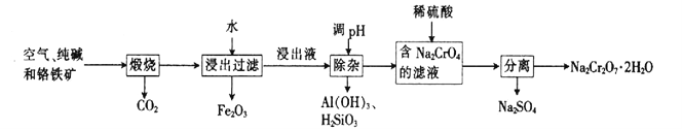
��1���Ǹ�������[Fe(CrO2)2]��Cr�Ļ��ϼ���___________��
��2����������Na2CrO4�Ļ�ѧ����ʽΪ___________��
��3���ữ��ҺNa2CrO4ʱ����ѡ�ø����ԭ����____________________����ƽ��Ƕȷ����ữ��ԭ����______________________��
��4���ù�����ij�ֲ�������������������ʵĻ�ѧʽΪ________________��
��5������ʯī�缫���Na2CrO4��Һ����ʵ��Na2CrO4��Na2Cr2O7��ת������ԭ����ͼ��ʾ��,
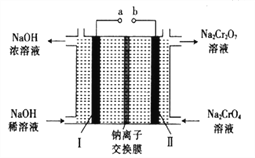
��д�����缫�ĵ缫��Ӧʽ_______________________��
����Na2CrO4ת��Ϊ1malNa2Cr2O7ʱ�����������缫��ת�Ƶ��ӵ����ʵ���Ϊ________��
��3����ȡ2.500g�ظ����ƾ�����������������ˮ���Ƴ�250ml��Һ������ȡ��25.00mL�ڵ���ƿ���������м���10mL2mol��L-1 H2SO4��Һ�������⻯��(���Ļ�ԭ����ΪCr3+)�����ڰ���5min��Ȼ�����100mLˮ������3mL����ָʾ������0.120mol��L-1��Na2S2O3����Һ���еζ�(������Ӧ��I2+2S2O32-=2I-+S4O62-)��
���жϴﵽ�ζ��յ��������______________________��
����ʵ���й���ȥ40.00mL��Na2S2O3����Һ�������ò�Ʒ�Ĵ���Ϊ_____________(�������������������ʲ����練Ӧ)(����3λ��Ч����)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com