
【题目】钼酸钠晶体(Na2MoO42H2O)是白色菱形结晶体,毒性较低,对环境污染污染程度低,可作新型水处理剂和金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的 MoS2)制备钼酸钠的两种途径如图所示。
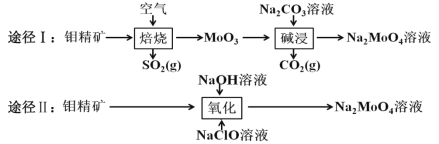
(1)途径Ⅰ焙烧过程中,为了提高焙烧效率,除增大空气量外还可以采用的措施有___; 在该过程的主要反应中,氧化剂与还原剂物质的量之比为________。
(2)途径Ⅱ氧化时还有 Na2SO4 生成,则反应的离子方程式为 ____________。
(3)已知途径Ⅰ的钼酸钠溶液中 c(MoO42-)=0.40 molL-1,c(CO32-)=0.10 molL-1。由钼酸钠溶液制备钼酸钠晶体时,需加入 Ba(OH)2 固体以除去 CO32-。在不损失 MoO42-的情况下,CO32-的最大去除率是 ____________ [已知 Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。
(4)途径Ⅱ中 Na2MoO4 溶液通过结晶的方法可得到 Na2MoO4 晶体。母液可以循环利用,但循环一定次数后必须对母液进行处理,试解释原因 _________。
(5)途径Ⅱ比途径Ⅰ的优点有 ________________(答出两条)。
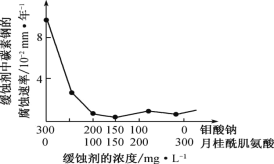
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图。
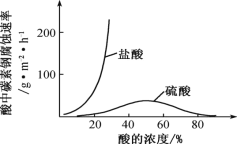
①当硫酸的浓度大于 90%时,碳素钢腐蚀速率几乎为零,原因是________________。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为 300 mgL-1,则缓蚀效果最好时钼酸钠(M=206 gmol-1)的物质的量浓度为 ________(计算结果保留 3 位有效数字)。
【答案】充分粉碎钼精矿,加压增大氧气浓度,升高温度等 7:2 MoS2+9ClO-+6OH-==MoO42-+9Cl-+3H2O 90% 多次使用后母液中杂质的浓度增大,再次重结晶时会析出杂质影响产品纯度 过程简单、不会产生污染性气体 浓硫酸具有强氧化性,常温下能使铁钝化 7.28×l0-4molL-1
【解析】
(1)根据影响化学反应速率因素作答;途径I焙烧过程中,反应物为氧气、钼精矿,产物为二氧化硫和三氧化钼,反应方程式为:2MoS2+7O2![]() 2MoO3+4SO2,据此分析;
2MoO3+4SO2,据此分析;
(2)途径Ⅱ氧化时MoS2与次氯酸钠、氢氧化钠溶液反应生成Na2MoO4和硫酸钠,据此分析;
(3)BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=![]() =1×10-7mol/L,溶液中碳酸根离子的浓度为:c(CO32-)=
=1×10-7mol/L,溶液中碳酸根离子的浓度为:c(CO32-)=![]() mol/L =1×10-2mol/L,可算去除率;
mol/L =1×10-2mol/L,可算去除率;
(4)母液当然含有一定量的产品,也含有一定量的杂质,所以到一定程度时,要进行净化; (5)从操作过程和环境角度作答;
(6)①浓硫酸具有强氧化性,常温下能使铁钝化;
②根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,缓蚀效果最好,据此计算。
(1)途径I为了提高钼精矿焙烧速率,粉碎钼精矿增大接触面积,增加氧气的浓度或升高温度;途径I焙烧过程中,反应物为氧气、钼精矿,产物为二氧化硫和三氧化钼,反应方程式为:2MoS2+7O2![]() 2MoO3+4SO2,其中氧化剂为氧气,还原剂为MoS2,则氧化剂与还原剂物质的量之比为7:2,答案为:充分粉碎钼精矿,加压增大氧气浓度,升高温度等;7:2;
2MoO3+4SO2,其中氧化剂为氧气,还原剂为MoS2,则氧化剂与还原剂物质的量之比为7:2,答案为:充分粉碎钼精矿,加压增大氧气浓度,升高温度等;7:2;
(2)途径Ⅱ氧化时MoS2与次氯酸钠、氢氧化钠溶液反应生成Na2MoO4和硫酸钠,利用化合价升降法结合原子守恒和电荷守恒配平,发生反应的离子方程式为MoS2+9ClO-+6OH-==MoO42-+9Cl-+3H2O,故答案为:MoS2+9ClO-+6OH-==MoO42-+9Cl-+3H2O;
(3) BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=![]() =1×10-7mol/L,溶液中碳酸根离子的浓度为:c(CO32-)=
=1×10-7mol/L,溶液中碳酸根离子的浓度为:c(CO32-)=![]() mol/L =1×10-2mol/L,所以碳酸根离子的去除率为:1-
mol/L =1×10-2mol/L,所以碳酸根离子的去除率为:1-![]() =1-10%=90%,故答案为:90%;
=1-10%=90%,故答案为:90%;
(4)重结晶的目的是提纯产品,母液当然含有一定量的产品,也含有一定量的杂质,所以到一定程度时,要进行净化,因为里面的杂质含量高了,故答案为:多次使用后母液中杂质的浓度增大,再次重结晶时会析出杂质影响产品纯度;
(5)从操作过程和环境角度可知,途径Ⅱ比途径Ⅰ的优点为:过程简单、不会产生污染性气体,故答案为:过程简单、不会产生污染性气体;
(6)①浓硫酸具有强氧化性,常温下能使铁钝化,故当硫酸的浓度大于90%时,腐蚀速率几乎为零,故答案为:浓硫酸具有强氧化性,常温下能使铁钝化;
②根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,缓蚀效果最好,
所以钼酸钠的浓度为:150mgL-1,1L溶液中含有的钼酸钠物质的量为:![]() ≈7.28×10-4mol,所以钼酸钠溶液的物质的量浓度为:7.28×l0-4molL-1,故答案为7.28×l0-4molL-1。
≈7.28×10-4mol,所以钼酸钠溶液的物质的量浓度为:7.28×l0-4molL-1,故答案为7.28×l0-4molL-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据你所学习的元素周期律和周期表知识回答下列相关问题:
(1)现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质是一种淡黄色固体,是黑火药成分之一 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(i)元素Y的氢化物的电子式为____,其水溶液呈碱性的原因是(用电离方程式表示):____;
(ii)元素Z与元素T相比,非金属性较强的是___(填元素符号);
(iii)探寻物质的性质差异性是学习的重要方法之一,T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是___(填化学式)。
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),把与下面元素有关的性质相符的曲线标号填入相应的空格中:
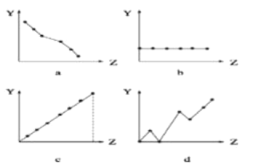
(i)IIA族元素的最外层电子数(填字母)____;
(ii)第三周期元素的最高化合价(填字母)____;
(iii)N3、O2、F、Na、Mg2、Al3的离子半径(填字母)___。
(3)周期表中某些元素化合物的易燃性、毒性变化有一定规律性,例如:
(i)氢化物的易燃性:第二周期___>__>H2O>HF,第三周期SiH4>PH3>___>___(填化学式);
(ii)化合物的毒性:PH3>NH3,H2S___H2O,CS2_CO2(选填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们的生活密切相关,请回答:
(1)在生活中要注意饮食平衡,蛋白质属于_______(填序号,下同)食物,番茄属于______食物;①酸性 ②碱性
(2)有四种常见药物①阿司匹林、②青霉素、③胃舒平、④麻黄碱. 某同学胃酸过多,应该服用______(填序号,下同);从用药安全角度考虑,使用前要进行皮肤敏感性测试的是_____;由于具有兴奋作用,国际奥委会严禁运动员服用的是_________;
(3)苹果汁是人们喜爱的饮品,由于其中含有Fe2+,现榨的苹果汁在空气中会由浅绿色变为棕黄色,若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有________(填序号);①氧化性 ②还原性 ③碱性 ④酸性
(4)食用植物油进入人体后,在酶的作用下水解为高级脂肪酸和_________(写名称),进而被氧化成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料;
(5)硫酸亚铁可用于治疗缺铁性贫血,某贫血患者每天须补充1.4g铁元素,则服用的药物中含硫酸亚铁的质量至少为_________g;
(6)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(﹣NH2)和____(写结构简式或名称).人体中共有二十多种氨基酸,其中人体自身________(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸;
(7)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水.写出葡萄糖在体内被氧化的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置、操作正确,且能实现相应实验目的的是:
实验装置 | 实验操作 | 实验目的 | |
A |
| 用标准KMNO4溶液滴定Na2S2O3溶液 | 测定Na2S2O3溶液浓度 |
B |
| 蒸发AlCl3溶液 | 得到AlCl3固体 |
C |
| 逐滴滴加 AgNO3 溶液 | 根据沉淀产生的先后顺序确定Ksp(A gCl)和Ksp(AgI)的大小 |
D |
| 加热 NH4Cl 固体 | 制备 NH3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可快速氧化 SO2。下列说法错误的是:

A.每活化一个氧分子放出 0.29 eV 能量
B.水可使氧分子活化反应的活化能降低 0.18 eV
C.氧分子的活化是氧氧共价键的断裂与碳氧共价键的生成过程
D.无水条件下该过程的活化能为 1.04 eV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018 年 11 月《Nature Energy》报道了中科院大连化学物理研究所科学家用 Ni-BaH2/Al2O3、Ni-LiH 等作催化剂,实现了在常压、100~300℃的条件下合成氨。
(1)在元素周期表中,Li、O、H 三种元素的电负性由大到小的顺序为___________;Al 原子核外电子空间运动状态有 8 种,则该原子处于____(填“基态”或“激发态”)。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为 182℃,沸点为 233℃。
①硝酸溶液中 NO3的空间构型为__________ 。
②甘氨酸中 N 原子的杂化类型为 ________,分子中σ键与π键的个数比为_________;其熔点、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为 141℃)的主要原因:一是甘氨酸能形成内盐,二是______________。
(3)[Cu(NH3)4]2+在实验室中制备方法如下:向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出蓝色沉淀溶解得到深蓝色溶液的离子方程式___________________。
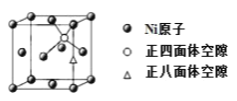
(4)X-射线衍射分析表明,由 Ni 元素形成的化合物 Mg2NiH4 的立方晶胞如图所示,其面心和顶点均被 Ni 原子占据,所有 Mg 原子的 Ni 配位数都相等。则 Mg 原子填入由 Ni 原子形成的 ___空隙中(填“正四面体”或“正八面体”),填隙率是____。
(5)已知 Mg2NiH4 晶体的晶胞参数为 646.5 pm,液氢的密度为0.0708 gcm-3。若以材料中氢的密度与液氢密度之比定义为储氢材料的储氢能力,在 Mg2NiH4 的储氢能力为____________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lg X=lg![]() 或lg
或lg![]() ,下列叙述正确的是
,下列叙述正确的是

A.25 ℃时,CO32-+H2O![]() HCO3-+OH-的平衡常数为1.0×10-7.6
HCO3-+OH-的平衡常数为1.0×10-7.6
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.曲线m表示pH与 -lg![]() 的变化关系
的变化关系
D.Ka1(H2CO3)的数量级为10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
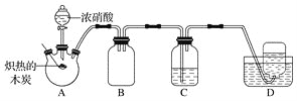
【题目】某化学小组采用如图所示装置,对浓硝酸与木炭的反应进行探究(已知:4HNO3![]() 4NO2↑+O2↑+2H2O)。
4NO2↑+O2↑+2H2O)。
请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至炽热状态,伸入三颈烧瓶中,生成的气体的颜色为__,产生该气体的反应的化学方程式是__。
(2)装置C中盛有足量Ba(OH)2溶液,炽热的木炭与浓硝酸反应后可观察到C中出现白色沉淀,该白色沉淀为__(填化学式)。
(3)装置B的作用是__。
(4)装置D中收集到了无色气体,有同学认为是NO,还有同学认为是O2。
①下列对该气体的检验方法合适的是__(填字母)。
A.敞口观察装置D中集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果D中集气瓶内收集到的无色气体是氧气,则氧气的来源是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识进行填空。
(1)49 g 的H2SO4的物质的量为______mol。
(2)标准状况下,5.1g氨气的体积是__________L。
(3)将53克Na2CO3 溶解在水中,配成500mL溶液,所得溶液中Na+物质的量浓度是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com