
【题目】利用“化学计量在实验中的应用”的相关知识进行填空。
(1)49 g 的H2SO4的物质的量为______mol。
(2)标准状况下,5.1g氨气的体积是__________L。
(3)将53克Na2CO3 溶解在水中,配成500mL溶液,所得溶液中Na+物质的量浓度是_____。
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是白色菱形结晶体,毒性较低,对环境污染污染程度低,可作新型水处理剂和金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的 MoS2)制备钼酸钠的两种途径如图所示。
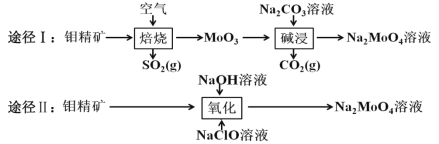
(1)途径Ⅰ焙烧过程中,为了提高焙烧效率,除增大空气量外还可以采用的措施有___; 在该过程的主要反应中,氧化剂与还原剂物质的量之比为________。
(2)途径Ⅱ氧化时还有 Na2SO4 生成,则反应的离子方程式为 ____________。
(3)已知途径Ⅰ的钼酸钠溶液中 c(MoO42-)=0.40 molL-1,c(CO32-)=0.10 molL-1。由钼酸钠溶液制备钼酸钠晶体时,需加入 Ba(OH)2 固体以除去 CO32-。在不损失 MoO42-的情况下,CO32-的最大去除率是 ____________ [已知 Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。
(4)途径Ⅱ中 Na2MoO4 溶液通过结晶的方法可得到 Na2MoO4 晶体。母液可以循环利用,但循环一定次数后必须对母液进行处理,试解释原因 _________。
(5)途径Ⅱ比途径Ⅰ的优点有 ________________(答出两条)。
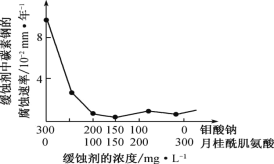
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图。
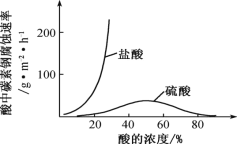
①当硫酸的浓度大于 90%时,碳素钢腐蚀速率几乎为零,原因是________________。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为 300 mgL-1,则缓蚀效果最好时钼酸钠(M=206 gmol-1)的物质的量浓度为 ________(计算结果保留 3 位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种二次锂离子电池工作时反应为:LixCn + Li(1-x)CoO2 == LiCoO2 + nC。电池如图所示。下列说法不正确的是
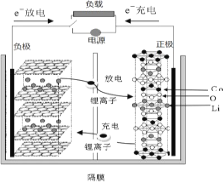
A.放电时,碳材料极失去电子,发生氧化反应,电子经外电路,Li+经内电路同时移向正极
B.放电时正极反应为: Li(1-x)CoO2 + xLi+ + xe- = LiCoO2
C.充电时, Li+从负极脱出,又嵌入正极
D.锂离子二次电池正负极之间充放电时发生传输 Li+的反应,少有副反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向碘水中滴加Na2SO3溶液时发生反应:Na2SO3+I2+H2O=2HI+Na2SO4,下列说法不正确的是
A.Na2 SO3为还原剂B.I2发生氧化反应
C.还原性:Na2SO3 > HID.每生成1molNa2SO4,理论上转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据新浪网报道:2019年8月2日,北京市房山区的瑞莱游泳健身馆发生疑似氯气泄漏,致多人呼吸道不适,出现头晕呕吐症状,61人送医治疗。氯气是一种重要的化工原料,在工农业生产生活中有着重要的应用。某化学兴趣小组同学利用以下装置制备氯气并对氯气的性质进行探究:
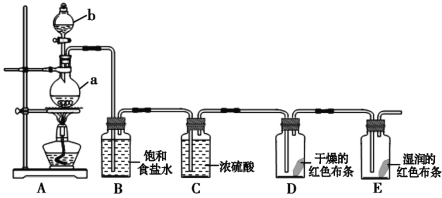
(1)仪器b的名称为___________。
(2)装置A中发生反应的离子方程式为:____________________________________。
(3)装置D中的实验现象为__________________,装置E中的实验现象为________
(4)整套实验装置存在着明显缺陷,你的改进措施是__________________________。
(5)8.7gMnO2固体与足量浓盐酸充分反应,在标准状况下产生Cl2的体积为_____L;其中被氧化的HCl的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W是否位于同一周期(填“是”或“否”):__________,理由是________________。
(2)Y是_______,Z是_______,W是_______。
(3)X、Y、Z和W可组成一种化合物,其原子个数比为8∶2∶4∶1,写出该化合物的名称及化学式: _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,关于离子浓度的说法正确的是( )
A.一定浓度的氨水加水稀释的过程中,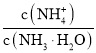 的比值减小
的比值减小
B.浓度均为0.1mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)<c(HCO3-),且3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
C.0.2mol·L-1的醋酸(CH3COOH)溶液与0.1mol·L-1NaOH溶液等体积混合后:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
D.已知浓度均为0.1mol·L-1的NH4Cl、NH3·H2O混合溶液显碱性,则c(NH4+)+2c(H+)=c(NH3·H2O)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要含Al2O3、SiO2,还有少量的Fe2O3)为原料制取Al2O3的流程如下:
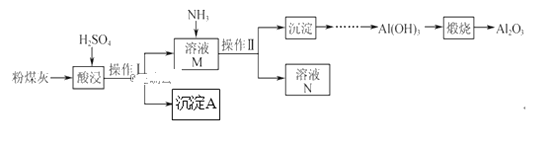
(1)操作Ⅰ的名称是__。
(2)用H2SO4“酸浸”时的离子方程式为__(任写一个)。
(3)简述如何检验酸浸后溶液中是否有Fe3+__。
(4)“煅烧”时的化学方程式为__。
(5)沉淀A与氢氟酸反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com