
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可快速氧化 SO2。下列说法错误的是:

A.每活化一个氧分子放出 0.29 eV 能量
B.水可使氧分子活化反应的活化能降低 0.18 eV
C.氧分子的活化是氧氧共价键的断裂与碳氧共价键的生成过程
D.无水条件下该过程的活化能为 1.04 eV
【答案】D
【解析】
A. 根据能量变化图分析,氧气最终变成活化氧,体系能量降低,则每活化一个氧气分子放出0.29eV能量,A项正确;
B. 反应过程中存在多步反应的活化能,根据能量变化图分析,整个反应的活化能应是活化能较大的,则没有水加入的反应活化能E=0.75eV,有水加入反应的活化能E=0.57eV,所以水可以使氧分子活化反应的活化能降低0.75eV-0.57eV=0.18eV,B项正确;
C. 根据能量变化图和题意,氧分子活化过程中氧氧的断裂,生成碳氧键,所以氧分子的活化是氧氧的断裂与碳氧键的生成过程,C项正确;
D. 根据能量变化图分析,整个反应的活化能应是活化能较大的,则没有水加入的反应活化能E=0.75eV,D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】不能正确表示下列变化的离子方程式的是
A.MnO2与浓盐酸加热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B.FeCl2溶液在空气中变质:12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓
C.NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
D.R-NH2电离:R-NH2+H2O![]() R-NH3++OH-
R-NH3++OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物阿比朵尔具有很好的抗病毒活性,其合成路线如下:
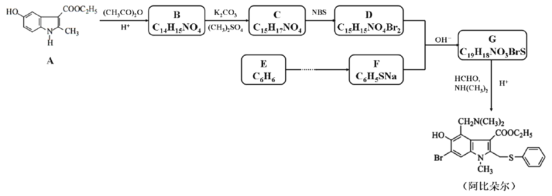
已知:①![]() +HCHO+
+HCHO+
![]()

②RX![]() RLiX
RLiX![]() RSH
RSH
请回答:
(1)下列说法正确的是___________。
A.化合物A能发生加成、取代和氧化反应,不发生还原反应
B.化合物B具有弱碱性
C.化合物D与FeCl3溶液发生显色反应
D.阿比朵尔的分子式是C22H25N2O3BrS
(2)写出化合物D的结构简式___________。
(3)写出G→阿比朵尔的化学方程式___________。
(4)设计从E→F的合成路线(用流程图表示,无机试剂任选)___________。
(5)写出化合物A同时符合下列条件的同分异构体的结构简式___________。
①1H-NMR谱和IR谱检测表明:分子中共有4种氢原子,含氮氧单键和碳氧双键;
②含有苯环和含氮五元杂环,且两环共棱连接。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3—CH=CH2+HBr→CH3—CHBr—CH3(主要产物),1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下面所示的一系列变化。
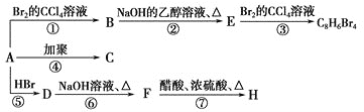
(1)A的化学式:________,A的结构简式________。
(2)上述反应中,①是________反应,⑦是________反应。(填反应类型)
(3)写出C,D,E,H物质的结构简式:
C_________,D_________,E_______,H________。
(4)写出DF反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A. H2O(g)===H2+1/2O2(g)ΔH=-485 kJ·mol-1
B. H2O(g)===H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是白色菱形结晶体,毒性较低,对环境污染污染程度低,可作新型水处理剂和金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的 MoS2)制备钼酸钠的两种途径如图所示。
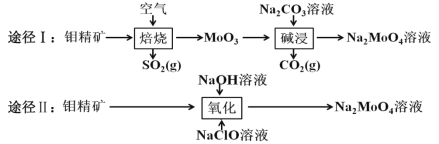
(1)途径Ⅰ焙烧过程中,为了提高焙烧效率,除增大空气量外还可以采用的措施有___; 在该过程的主要反应中,氧化剂与还原剂物质的量之比为________。
(2)途径Ⅱ氧化时还有 Na2SO4 生成,则反应的离子方程式为 ____________。
(3)已知途径Ⅰ的钼酸钠溶液中 c(MoO42-)=0.40 molL-1,c(CO32-)=0.10 molL-1。由钼酸钠溶液制备钼酸钠晶体时,需加入 Ba(OH)2 固体以除去 CO32-。在不损失 MoO42-的情况下,CO32-的最大去除率是 ____________ [已知 Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。
(4)途径Ⅱ中 Na2MoO4 溶液通过结晶的方法可得到 Na2MoO4 晶体。母液可以循环利用,但循环一定次数后必须对母液进行处理,试解释原因 _________。
(5)途径Ⅱ比途径Ⅰ的优点有 ________________(答出两条)。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图。
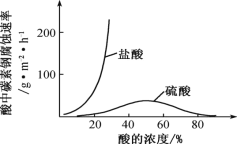
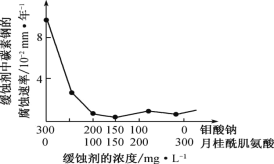
①当硫酸的浓度大于 90%时,碳素钢腐蚀速率几乎为零,原因是________________。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为 300 mgL-1,则缓蚀效果最好时钼酸钠(M=206 gmol-1)的物质的量浓度为 ________(计算结果保留 3 位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米氧化锌是一种多功能性的新型无机材料,在橡胶、玻璃、涂料等各个领域广泛的应用。工业由粗氧化锌(含少量FeO、CuO 等杂质) 制备活性氧化锌的工业流程如下:

已知:Fe3+、Fe2+、Cu2+完全沉淀的pH分别是:3.2,8.1,6.7
(1)“酸浸”时用的硫酸溶液的密度为1.4g/mL,质量分数为70%,则该硫酸的物质的量浓度为____。
(2)焙烧前粉碎的目的是____________________________________________。
(3)滤液中加锌粉的目的是_____________________________________。
(4)物质A的主要成分_______________(填化学式),检验A中阳离子的方法是_______________。
(5)滤液中加H2O2发生反应的离子方程式__________________________。
(6)6.82g碱式碳酸锌[aZn(OH)2·bZnCO3·cH2O]恰好溶解在40mL3mol/LHCl中,同时产生448mLCO2(标准状况下),试推算碱式碳酸锌的化学式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据新浪网报道:2019年8月2日,北京市房山区的瑞莱游泳健身馆发生疑似氯气泄漏,致多人呼吸道不适,出现头晕呕吐症状,61人送医治疗。氯气是一种重要的化工原料,在工农业生产生活中有着重要的应用。某化学兴趣小组同学利用以下装置制备氯气并对氯气的性质进行探究:
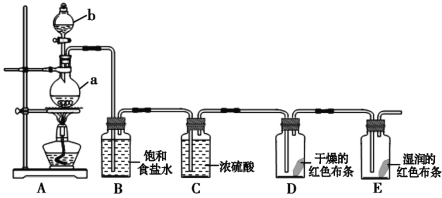
(1)仪器b的名称为___________。
(2)装置A中发生反应的离子方程式为:____________________________________。
(3)装置D中的实验现象为__________________,装置E中的实验现象为________
(4)整套实验装置存在着明显缺陷,你的改进措施是__________________________。
(5)8.7gMnO2固体与足量浓盐酸充分反应,在标准状况下产生Cl2的体积为_____L;其中被氧化的HCl的物质的量为_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com