
【题目】下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A. C2H5OH(l)+3O2(g)![]() 2CO2(g)+3H2O(g) ΔH=1 367.0 kJ/mol(燃烧热)
2CO2(g)+3H2O(g) ΔH=1 367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)![]() NaCl(aq)+H2O(l) ΔH=+57.3 kJ/mol(中和热)
NaCl(aq)+H2O(l) ΔH=+57.3 kJ/mol(中和热)
C. S(s)+O2(g)![]() SO2(g) ΔH=296.8 kJ/mol(反应热)
SO2(g) ΔH=296.8 kJ/mol(反应热)
D. 2NO2![]() O2+2NO ΔH=+116.2 kJ/mol(反应热)
O2+2NO ΔH=+116.2 kJ/mol(反应热)
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ、火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为__________________________。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
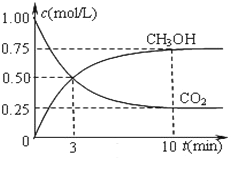
在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行反应。测得CO2和CH3OH(g)浓度随时间变化如图所示。回答:0~10 min内,氢气的平均反应速率为___mol/(L·S);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_________(填“正向”、“逆向”或“不”)移动。
Ⅱ、如下图所示C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。
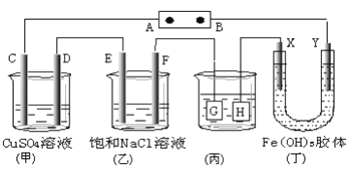
(1)若用甲醇、空气燃料电池作电源,电解质为KOH溶液,则A极的电极反应式为_________________________
(2)欲用(丙)装置给铜镀银,银应该是 _____电极(填G或H)
(3)(丁)装置中Y极附近红褐色变_______(填深或浅)
(4)通电一段时间后,C、D、E、F电极均有单质生成,其物质的量之比为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
A. 碘与干冰分别受热变为气体
B. 硝酸铵与硝酸分别受热变为气体
C. 氯化钠与氯化氢分别溶解在水中
D. 晶体钠与冰分别受热熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。请回答下列问题:
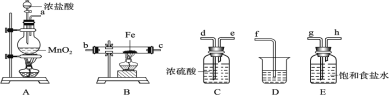
(1)A 中发生反应的化学方程式为________________________。在该反应中当 0.4molHCl发生反应时,生成标准状况下的Cl2 的体积为______。浓盐酸在反应中显示出来的性质是__(填序号);
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)各装置的正确连接顺序为(填写装置代号)A→_____→_____→_____→D。
(3)装置 E 的作用是_______。写出装置 D(D中所盛溶液为 NaOH)中反应的化学方程式_______
(4)工业上用电解法制备氯气的化学方程式为:____________。
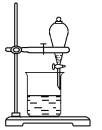
Ⅱ.某小组用CCl4萃取碘水中的碘,在下图的分液漏斗中,下层液体呈__________色;他们打开分液漏斗活塞,却未见液体流下,原因可能是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A. υ(A)= 0.5 mol/(L·s) B. υ(B)= 18 mol/(L·min)
C. υ(C)= 0.8 mol/(L·s) D. υ(D)= 1 mol/( L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=__________kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=_________kJ·mol-1
(2)反应①的化学平衡常数K的表达式为_______________;③的化学平衡常数K的表达式为_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种工业盐,外观与食盐相似。下面是某学习小组设计的NaNO2制取实验和纯度检验实验。该小组收集了相关资料:
①SO2和HNO3溶液反应生成NOx和H2SO4
②3NO2-+2H+=2NO↑+NO3-+H2O
③NO2-+Ag+=AgNO2↓(AgNO2为淡黄色接近白色固体,在水中形成沉淀)
Ⅰ.亚硝酸钠的制取实验

(1)仪器a的名称为________________________,A装置中发生的化学反应方程式为_____________________________________________。
(2)B装置中多孔球泡的作用是_________________________________________________。
(3)若装置B中逸出的NO与NO2气体物质的量之比为2∶1,则装置B中发生反应的化学方程式为_________________________________________________________。
(4)实验过程中需控制C装置中溶液pH>7,否则C中生成的NaNO2的产量会下降,理由是_____________________________________________________。
(5)请根据题干所给信息设计实验证明C装置中有NO2产生:_________________________________。(限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液)
Ⅱ.亚硝酸钠的纯度检验
已知:NO2-+MnO4-+H+→NO3-+Mn2++H2O
(6)反应结束后C中溶液通过结晶获得NaNO2粗产品mg,溶解后稀释至250mL,分别取25.00mL用cmol/L的酸性KMnO4溶液平行滴定三次,平均每次消耗酸性KMnO4溶液的体积为VmL。则粗产品中NaNO2的质量分数为_____________(用含c、V、m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
K为化学平衡常数,其中K和温度的关系如下表:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根据以上信息推断以下说法正确的是
A. 此反应为放热反应
B. 此反应只有达到平衡时,密闭容器中的压强才不会变化
C. 此反应达到1 000℃时的反应速率比700℃时大
D. 该反应的化学平衡常数越大,反应物的转化率越低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸气完全燃烧的热化学方程式为_____________________________________
(2)反应②中的能量变化如图所示,则ΔH2=__________。(用E1、E2的相关式子表示)

(3)H2(g)的燃烧热为________。
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:________________(写出两点即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com