
| A. | 葡萄糖注射液不能产生丁达尔效应,不属于胶体 | |
| B. | 油脂是高分子化台物,水解可生成甘油和高级脂肪酸 | |
| C. | 煤中含有的煤焦油,可由煤干馏获得 | |
| D. | 聚乙烯塑料的老化是因为发生了加成反应 |
分析 A、胶体具有丁达尔效应,溶液和浊液不具有,葡萄糖注射液为葡糖糖水溶液;
B、油脂相对分子质量较小,可以在三种不同条件下发生水解,条件不同,产物不同;
C、煤焦油为煤的干馏的一种产物,而不是煤本身的一种组分;
D、聚乙烯塑料的老化是因为发生了氧化反应.
解答 解:A、在三种分散系中,只有胶体具有丁达尔效应,葡萄糖注射液不能产生丁达尔效应,所以不属于胶体,应该属于溶液,故A正确;
B、油脂是高级脂肪酸甘油酯,相对分子质量较小,达不到高分子的标准,油脂可以在酸性、碱性、酶催化三种条件下发生水解,而在碱性条件下的水解产物就不是甘油和高级脂肪酸,而是高级脂肪酸盐和甘油,故B错误;
C、煤通过干馏可以生成煤焦油,属于化学变化,有新物质生成,而不是煤中本身含有煤焦油,煤焦油是后来反应得到的,故C错误;
D、聚乙烯塑料的老化是因为发生了氧化反应,故D错误;
故选A.
点评 在化学反应中,反应的条件不同产物可能就不同,并不是复杂一点的有机物就属于高分子,所有烷烃均互为同系物,与同分异构现象无关,本题D是易错点,反应生成和本身含有是两码事.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| B. | 在铁制品上镀铜时,石墨为阳极,铁制品作阴极,铜盐为电镀液 | |
| C. | 用锡焊接的铁质器件,焊接处易生锈 | |
| D. | 燃气灶上的炒锅支架容易生锈,主要是由于高温下铁易发生“化学腐蚀” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素的化学式都是(C6H10O5)n,故互为同分异构体 | |
| B. | 不含杂质的天然油脂属于高分子化合物,有固定的熔、沸点 | |
| C. | 蔗糖、植物油、天然蛋白质完全燃烧后的最终产物均为C02和H20 | |
| D. | 纤维素乙酸酯、油脂、蛋白质和麦芽糖在一定条件下都能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:
目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场.因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题.目前,汽车厂滴常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场.因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题.目前,汽车厂滴常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.| 实验编号 | 实验目的 | T/℃ | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 同质量的同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.5×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究同质量的同种催化剂的比表面积对尾气转化速率的影响 | 280 | 6.5×10-3 | 4.00×10-3 | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.5×10-3 | 4.00×10-3 | 80 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
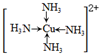
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X能与某些非金属元素化合 | |
| B. | X可能为金属元素 | |
| C. | X原子的最外层电子数和核电荷数肯定为奇数 | |
| D. | X可能形成化学式为KXO3的盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com