
【题目】已知有如图所示物质间的相互转化,已知A是一种金属单质。

试回答:
(1)写出下列物质的化学式B________,D________;
(2)写出由E转变成F的化学方程式________;
(3)写出下列反应的离子方程式:D溶液与AgNO3反应________;向G溶液加入A的有关离子反应方程式________;
(4)焰色反应是________变化(填“物理”或“化学”)。
【答案】FeCl2 KCl 4Fe(OH)2+O2+2H2O══4Fe(OH)3 Cl- + Ag+ ══AgCl↓ 2Fe3++ Fe══3Fe2+ 物理
【解析】
白色沉淀E在空气中变化为红褐色沉淀F,说明E为Fe(OH)2,F为Fe(OH)3,F与盐酸反应生成G为FeCl3,金属A与氯化铁反应生成B,B与C反应得到E与D,故A为Fe,B为FeCl2,则Fe与盐酸反应生成氢气与氯化亚铁;D溶液和硝酸酸化的硝酸银反应生成白色沉淀H为AgCl,溶液透过钴玻璃进行焰色反应为紫色,证明溶液中含有钾元素,故D为KCl,则C为KOH,据此分析解答。
(1)根据以上分析,B的化学式为FeCl2,D的化学式为KCl,故答案为:FeCl2;KCl;
(2)由E转变成F是氢氧化亚铁被氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)D为KCl,D溶液与AgNO3溶液反应的离子方程式为Ag++Cl-=AgCl↓;向G(FeCl3)溶液中加入A(Fe)发生氧化还原反应,反应的离子方程式为Fe+2Fe3+=3Fe2+,故答案为:Ag++Cl-=AgCl↓;Fe+2Fe3+=3Fe2+;
(4)焰色反应过程中没有新物质生成,属于物理变化,故答案为:物理。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某有机物A由C、H、O三种元素组成,相对分子质量为90。将4.5 g A完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重2.7 g和6.6 g。A能与NaHCO3溶液产生CO2,且两分子A之间脱水可生成六元环状化合物。有关A的说法正确的是
A. 有机物A的分子式为C3H8O3
B. 0.1 mol A与足量Na反应生成2.24 L H2
C. A催化氧化的产物不能发生银镜反应
D. A能在一定条件下发生缩聚反应生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。
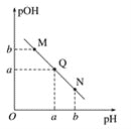
图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学配制一定物质的量浓度的NaOH溶液时,造成所配制溶液浓度偏高的原因是( )
A. 转移时容量瓶未干燥
B. 定容时俯视刻度线
C. 没有洗涤烧杯和玻璃棒
D. 用带游码的托盘天平称2.4 g NaOH时误用了“左码右物”方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某教师在课堂上用下图所示的装置来验证浓硫酸与铜是否发生反应并探讨反应所产生气体的性质。

请回答下列问题:
(1)通过试管乙中发生的____现象,说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有______性。
(2)若要收集试管甲中生成的气体,可以采用_________方法收集(填序号)。
①排水取气法 ② 向上排空气取气法 ③ 向下排空气取气法
(3)写出试管甲中所发生反应的化学反应方程式__________。
(4)试管乙口部浸有碱液的棉花的作用是__________,此防范措施也说明产生的气体是 ______气体(填“酸性”、“中性”或“碱性”),_______(填“有”或“无”)毒性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2,发生反应:2C(s)+2NO2(g)N2(g)+2CO2(g)反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法正确的是

A.T℃时,该反应的化学平衡常数为![]()
B.图中c点所示条件下,v(正)>v(逆)
C.向a点平衡体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡大
D.容器内的压强:Pa:Pb>6:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A. 在![]() 分子中含有1个手性C原子
分子中含有1个手性C原子
B. 氢键是一种特殊化学键,它广泛地存在于自然界中
C. 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子
D. 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大
查看答案和解析>>
科目:高中化学 来源: 题型:
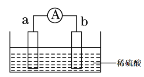
【题目】(1)如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则电子由_____(填“a”或“b”,下同) 极流向_____极,电解质溶液中![]() 移向_____极,a极上的电极反应式为___________________。
移向_____极,a极上的电极反应式为___________________。
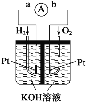
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为___________,若将燃料改为CH4,写出其负极反应方程式_________。
(3)图为青铜器在潮湿环境中因发生电化学反应而被腐蚀的原理示意图。

①腐蚀过程中,负极是_________(填图中字母“a”或“b”或“c”);
②环境中的Cl- 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为_______________________;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为_______L(标况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
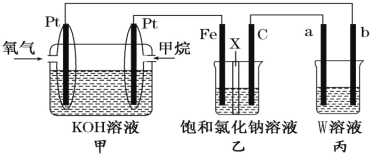
(1)石墨电极(C)作_________极,若丙池中W为Na2SO4溶液并滴有酚酞,实验开始后观察到的现象是________甲中甲烷燃料电池的负极反应式为___________________________。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为_________ L。
(3)若丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是__________________。
A.b电极为粗铜 B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变 D.利用阳极泥可回收Ag、Pt、Au等金属
(4)假设乙装置中氯化钠溶液足够多,若在标准状况下,有224 mL氧气参加反应,则乙装置中阳离子交换膜,左侧溶液质量将__________________,(填“增大”“减小”或“不变”),且变化了__________________克。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com