
【题目】下列有关叙述正确的是( )
A. 在![]() 分子中含有1个手性C原子
分子中含有1个手性C原子
B. 氢键是一种特殊化学键,它广泛地存在于自然界中
C. 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子
D. 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1) 一定温度下,发生反应: 2 SO2(g)+ O2 (g)![]() 2SO3(g)(反应条件己略),现向2L密闭容器中充入4.0 mol SO2和2.0 mol O2发生反应,测得n (O2) 随时间的变化如下表:
2SO3(g)(反应条件己略),现向2L密闭容器中充入4.0 mol SO2和2.0 mol O2发生反应,测得n (O2) 随时间的变化如下表:

①0~2 min内,v(SO2)=_______________
②达到平衡时SO3的物质的量浓度为____________
③下列可证明上述反应达到平衡状态的是____________(填序号)。
a. v(O2)=2v(SO3)
b. O2的物质的量浓度不再变化
c.每消耗1molO2,同时生成2molSO3
d.容器内压强保持不变
(2)已知可逆反应: 2NO2(g) (红棕色) ![]() N2O4(g) (无色),正反应为放热反应。将装有NO2和N2O4混合气体的烧瓶放入热水中,观察到的现象______________ ,产生该现象的原因是________________
N2O4(g) (无色),正反应为放热反应。将装有NO2和N2O4混合气体的烧瓶放入热水中,观察到的现象______________ ,产生该现象的原因是________________
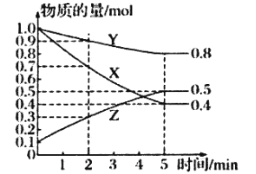
(3)某温度下的密闭容器中,X、Y、Z三种气体的物质的量随时间变化曲线如图,则该反应的化学方程式为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.NaHCO3与足量Ca(OH)2的反应: 2HCO3-+Ca2++2OH-=CaCO![]() ↓+CO32-+2H2O
↓+CO32-+2H2O
B.少量Na投入冷水中;Na+2H2O=Na++OH-+H2↑
C.CuSO4与Ba(OH)2的反应: Cu2++ SO42-+Ba2++2OH![]() =Cu(OH)2↓+BaSO4↓
=Cu(OH)2↓+BaSO4↓
D.AlCl3溶液中加入足量氨水:Al3++4OH![]() =AlO2-+2H2O
=AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有如图所示物质间的相互转化,已知A是一种金属单质。

试回答:
(1)写出下列物质的化学式B________,D________;
(2)写出由E转变成F的化学方程式________;
(3)写出下列反应的离子方程式:D溶液与AgNO3反应________;向G溶液加入A的有关离子反应方程式________;
(4)焰色反应是________变化(填“物理”或“化学”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸罗替戈汀是一种用于治疗帕金森病的药物,其合成路线流程图如下:

(1) 、CH3CH2CH2NH2中所含官能团的名称分别为 ______、 ________。
、CH3CH2CH2NH2中所含官能团的名称分别为 ______、 ________。
(2)D→E的反应类型是_______。
(3)B的分子式为C12H12O2,写出B的结构简式;____ 。
(4)C的一种同分异构体X同时满足下列条件,写出X的结构简式:_______。
①含有苯环,能使溴水褪色;
②能在酸性条件下发生水解,水解产物分子中所含碳原子数之比为6:5,其中一种水解产物分子中含有3种不同化学环境的氢原子。
(5)已知:![]()
![]() R3COOH+
R3COOH+![]() ,写出以
,写出以![]() 和
和![]() 为原料制备
为原料制备 的合成路线流程图_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸香叶酯是一种食品香料,可以由香叶醇与甲酸发生酯化反应制得。下列说法正确的是( )
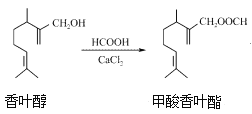
A. 香叶醇的分子式为C11H18O
B. 香叶醇在浓硫酸、加热条件下可发生消去反应
C. 香叶醇与CH2=CHCH=CHCH2OH互为同系物
D. 香叶醇与甲酸香叶酯均不能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是制造化肥的重要原料,如图为工业合成氨的流程图。下列有关说法错误的是
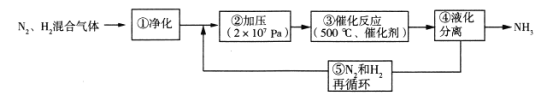
A.工业上制氮气一般用分离液态空气法
B.步骤②、③、④、⑤均有利于提高反应物的平衡转化率
C.步骤①中“净化”N2、H2混合气体可以防止催化剂中毒
D.步骤③中温度选择500℃,主要是考虑催化剂的活性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向等体积(V0mL)等浓度(0.1 mol .L-1)的盐MCl、NaR、MR溶液中分别加入蒸馏水,使其稀释VmL,稀释过程中,溶液的pH与lg![]() 的关系如图所示。下列有关说法正确的是
的关系如图所示。下列有关说法正确的是
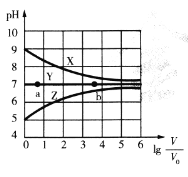
A.曲线X对应的盐为NaR,MCl为强酸强碱盐
B.对于曲线Y,a点水的电离程度比b点小
C.常温下,MOH的电离平衡常数Kb的数量级为10-3
D.曲线Z上任何一点对应溶液中均存在c(H+) =c(OH-) +c( MOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A、B是中学常见的物质,其阴阳离子可从表中选择.
阳离子 | K+、Na+、NH4+、Fe2+、Ba2+、Cu2+ |
阴离子 | OH﹣、I﹣、NO3﹣、AlO2﹣、HCO3﹣、HSO4﹣ |
(1)若A的水溶液为无色,B的水溶液呈碱性,A、B的水溶液混合后,只产生不溶于稀硝酸的白色沉淀及能使湿润的红色石蕊试纸变蓝的气体,则:
①A中的化学键类型为_________(填“离子键”、“共价键”).
②A、B溶液混合后加热呈中性,该反应的离子方程__________________________ .
(2)若A的水溶液为浅绿色,B的焰色反应呈黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合后无明显变化.则:
①A的化学式为__________________________ .
②经分析上述过程中溶液变黄的原因可能有两种(请用文字叙述)
Ⅰ._______________________.Ⅱ._________________________.
③请用一简易方法证明上述溶液变黄的原因_________________________.
④利用上述过程中溶液变黄原理,将其设计成原电池,若电子由a流向b,则b极的电极反应式为_.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com