
【题目】氨是制造化肥的重要原料,如图为工业合成氨的流程图。下列有关说法错误的是
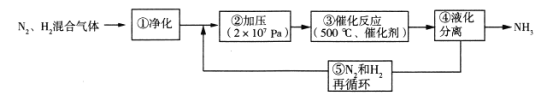
A.工业上制氮气一般用分离液态空气法
B.步骤②、③、④、⑤均有利于提高反应物的平衡转化率
C.步骤①中“净化”N2、H2混合气体可以防止催化剂中毒
D.步骤③中温度选择500℃,主要是考虑催化剂的活性
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室制得气体中常含有杂质,影响其性质检验。下图A为除杂装置,B为性质检验装置,完成下列表格:
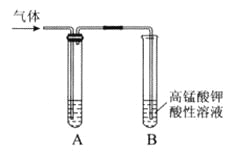
序号 | 气体 | 反应原理 | A中试剂 |
① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | _________ |
② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是________________。 | NaOH溶液 |
③ | 乙炔 | 电石与饱和食盐水反应 | _________ |
Ⅱ.为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
试管编号 | ① | ② | ③ |
实验操作 |
|
|
|
实验现象 | 酯层变薄 | 酯层消失 | 酯层基本不变 |
(1)试管①中反应的化学方程式是_____________________;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是________________;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某教师在课堂上用下图所示的装置来验证浓硫酸与铜是否发生反应并探讨反应所产生气体的性质。

请回答下列问题:
(1)通过试管乙中发生的____现象,说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有______性。
(2)若要收集试管甲中生成的气体,可以采用_________方法收集(填序号)。
①排水取气法 ② 向上排空气取气法 ③ 向下排空气取气法
(3)写出试管甲中所发生反应的化学反应方程式__________。
(4)试管乙口部浸有碱液的棉花的作用是__________,此防范措施也说明产生的气体是 ______气体(填“酸性”、“中性”或“碱性”),_______(填“有”或“无”)毒性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A. 在![]() 分子中含有1个手性C原子
分子中含有1个手性C原子
B. 氢键是一种特殊化学键,它广泛地存在于自然界中
C. 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子
D. 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辛烯醛是一种重要的有机合成中间体,沸点为177℃,密度为0.848 g·cm-3,不溶于水。实验室采用正丁醛制各少量辛烯醛,反应原理为:
CH3CH2CH2CHO![]()

![]()
![]()
实验步骤如下:
步骤Ⅰ:向三颈烧瓶中加入6.3 mL 2% NaOH溶液,在充分搅拌下,从恒压滴液漏斗慢慢滴入5mL正丁醛。
步骤Ⅱ:充分反应后,将反应液倒入如图仪器中,分去碱液,将有机相用蒸馏水洗至中性。

步骤Ⅲ:经洗涤的有机相加入适量无水硫酸钠固体,放置一段时间后过滤。
步骤Ⅳ:减压蒸馏有机相,收集60~70℃/1.33~4.00kPa的馏分。
(l)步骤Ⅰ中的反应需在80℃条件下进行,适宜的加热方式为___ 。使用冷凝管的目的是 _______。
(2)步骤Ⅱ中所用仪器的名称为_____ 。碱液在仪器中处于_____(填“上层”或“下层”),如何判断有机相已经洗至中性:______。
(3)步骤Ⅲ中加入无水硫酸钠固体的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
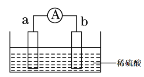
【题目】(1)如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则电子由_____(填“a”或“b”,下同) 极流向_____极,电解质溶液中![]() 移向_____极,a极上的电极反应式为___________________。
移向_____极,a极上的电极反应式为___________________。
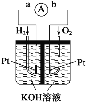
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为___________,若将燃料改为CH4,写出其负极反应方程式_________。
(3)图为青铜器在潮湿环境中因发生电化学反应而被腐蚀的原理示意图。

①腐蚀过程中,负极是_________(填图中字母“a”或“b”或“c”);
②环境中的Cl- 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为_______________________;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为_______L(标况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是
A. 2NaHCO3![]() Na2CO3+CO2↑+H2O B. Na2O+H2O=2NaOH
Na2CO3+CO2↑+H2O B. Na2O+H2O=2NaOH
C. 2KI+Br2=2KBr+I2 D. MgO+2HCl=MgCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 室温下用稀NaOH溶液吸收Cl2:Cl2+2OH![]() ClO+Cl+H2O
ClO+Cl+H2O
B. 用铝粉和NaOH溶液反应制取少量H2:Al+2OH![]()
![]() +H2↑
+H2↑
C. 室温下用稀HNO3溶解铜:Cu+2![]() +2H+
+2H+![]() Cu2++2NO2↑+H2O
Cu2++2NO2↑+H2O
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+![]() H2SiO3↓+2Na+
H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝电池性能优越,Al-Ag2O2电池用于电解尿素[CO(NH2)2]的碱性溶液制备氢气(隔膜Ⅱ仅阻止气体通过,a、b均为惰性电极)。下列说法正确的是( )

A.Ag电极是正极,反应后该电极区溶液pH减小
B.原电池的总反应为:2Al+3Ag2O2+2NaOH═2NaAlO2+3Ag2O+H2O
C.每消耗2.7g铝,理论上a、b两极共产生气体3.36L(标准状况)
D.a电极上的电极反应为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com