
有三瓶标签脱落的无色透明溶液,分别是稀盐酸、稀硫酸和稀硝酸。请你帮助实验老师设计两种方法鉴别它们。
| | 操 作 步 骤 | 现 象 及 结 论 |
| 方法一 | | |
| 方法二 | | |
操 作 步 骤 现 象 及 结 论 方法一 (1)各取少量溶液于试管中,分别滴加BaCl2溶液(2)各取剩余的两种溶液于试管中,分别滴加AgNO3溶液 (1)产生白色沉淀的是稀硫酸(2)产生白色沉淀的是稀盐酸,剩余的是稀硝酸 方法二 (1)各取少量溶液于试管中,分别加入铜片
(2)各取剩余的两种溶液于试管中,分别滴加BaCl2溶液有气泡产生的是稀硝酸
产生白色沉淀的是稀硫酸,剩余的是稀盐酸
解析试题分析:据盐酸与硝酸银反应生成难溶于水的AgCl沉淀,硫酸与BaCl2反应生成BaSO4沉淀,以及硝酸具有强氧化性可设计两种实验方案:方案一:可加入BaCl2溶液鉴别出稀硫酸,再加入AgNO3溶液,生成沉淀的为盐酸;方案二:根据硝酸具有强氧化性,与铜反应生成NO气体,剩余两种溶液加入BaCl2溶液,生成沉淀的是硫酸.
考点:物质的检验和鉴别的实验方案设计;常见阴离子的检验


 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:填空题
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422 ℃,沸点1366 ℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
(1)在粗盐除杂的反应I中加Na2CO3溶液的作用是 ;
滤渣的主要成分: 。
(2)反应Ⅱ完成后溶液中主要溶质是 。
(3)反应IV和VI都是制备CuCl的化学过程:
①反应IV加入的Cu必须过量,其目的是 。
②写出反应VI的离子方程式 。
(4)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图所示是分离混合物时常用的仪器,回答下列问题: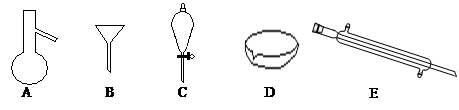
(1)写出仪器C、E的名称 、
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符号)
①NaCl固体和泥沙: ②花生油和水:
(3)下列关于仪器的使用说法正确的是
A.A仪器可以用酒精灯直接加热
B.B仪器可以用于向酒精灯中添加酒精ks5u
C.C仪器在放出液体时应打开上边的瓶塞
D.在实验室应用D仪器进行实验时要不断用玻璃棒搅拌
E.制蒸馏水时E仪器中水的流向是上进下出
(4)若向C装置中加入碘水和足量CCl4,充分振荡后静置,会观察到什么现象?
(5)碘单质和溴单质有相类似的性质,都可以用有机溶剂萃取水溶液中的单质,若利用C仪器提取溴水中的溴单质,下列有机溶剂中不能选用的是:
A.汽油 B.CCl4 C.酒精 D.醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O  ZnFe2O4+2CO2↑+4CO↑+6H2O ……………(b)
ZnFe2O4+2CO2↑+4CO↑+6H2O ……………(b)
(1)上述制备原理中属于氧化还原反应的是 (选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ、(NH4)2Fe(SO4)2·6H2O,Ⅱ、ZnSO4·7H2O及Ⅲ、(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n(Zn2+)= 。
②选用的加料方式是 (填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,然后升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成配制溶液乙,甲、乙同时加热到75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤完全的依据是 。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有 和 。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息利用实验可提供的试剂制取纯净的ZnSO4溶液。
实验中可选用的试剂如下:
(a)30%H2O2;(b)新制氯水;
(c)1.0 mol·L-1NaOH溶液;
(d)3mol·L-1稀硫酸;
(e)纯ZnO粉末;
(f)纯锌粉。
实验步骤依次为:①将锌片完全溶于稍过量的3mol·L-1稀硫酸,加入 (选填字母,下同);②加入 ;③加热到60℃左右并不断搅拌;
④过滤得ZnSO4溶液。其中步骤③加热的主要目的有 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg,流程如下图所示: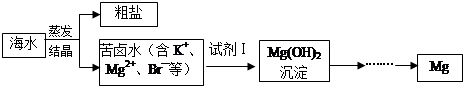
(1)工业制取镁的方法是 法。
(2)试剂Ⅰ一般选用 (填化学式)。
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。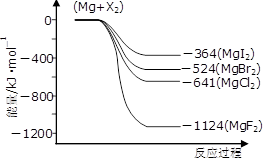
①由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应;推测化合物的热稳定性顺序为MgI2 MgF2(填“>”、“=”或“<”)。
②依上图数据写出MgBr2(s)与Cl2(g)反应的热化学方程式 。
(4)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体生成。写出CH3MgCl水解的化学方程式 。
(5)向Mg(OH)2中加入NH4Cl溶液,可使沉淀溶解,请结合平衡原理和必要的文字解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
除去下列物质中所含少量杂质,填写所选用的试剂和分离方法
| | 混合物 (括号内为少量杂质) | 试剂 (足量) | 分离方法 |
| A | 苯(苯酚) | | |
| B | 乙烯(SO2) | | |
| C | 乙酸乙酯(乙酸) | | |
| D | 乙醇(水) | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下图:
(1)电解精练银时,阴极反应式为_______________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该红棕色气体与水反应的化学方程式为_______________________________________。
(2)固体混合物B的组成为_____________;在生成固体B的过程中,必须控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为_____________________。
(3)煅烧过程中生成的氧化产物与NH3在催化剂条件下反应的化学方程式为_____________________。这个反应中会有白烟产生,该白烟为______________。
(4)若银铜合金中铜的质量分数为64%,理论上3.0kg废料中的铜可完全转化为__________molCuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液___________L。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(16分)某同学从网络上了解到菠菜中富含可溶性的两类正盐:草酸盐和碳酸盐。该同学欲用实验验证这一事实并检测其中草酸盐的含量。查阅资料得知草酸(H2C2O4)是一种二元有机弱酸,具有较强的还原性;草酸钙(CaC2O4)不溶于水能溶于稀硫酸。请回答下列问题:
(1)该学生将菠菜研磨成粉末、热水浸泡、过滤得到澄清溶液A。研磨菠菜使用的实验仪器的名称为 。
(2)设计实验方案验证菠菜中含有草酸盐和碳酸盐,补充完成预期现象和结论。
| 实验步骤 | 预期现象和结论 |
| 步骤1:调节溶液A至弱碱性,滴加足量CaCl2溶液。 | ①出现白色沉淀,说明菠菜中 。 |
| 步骤2:取步骤1的沉淀于试管中,加入足量的稀硫酸,沉淀完全溶解,并将产生的无色无味的气体通入澄清石灰水中。 | ② 。 |
| 步骤3:向步骤2得到的溶液中滴加几滴高锰酸钾溶液。 | ③ 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)CoCl2·6H2O是一种饲料营养强化剂。一种利用水钻矿(主要成分为CO2O3、Co
(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
已知:①浸出液含有的阳离了主要有H+、CO2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01 mo1·L-l)
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaC1O3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至a'’,过滤所得到的沉淀成分为____ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是 :其使用的最佳pH范围是____ 。
| A.2.0~2.5 | B.3.0~3.5 | C.4.0~4.5 | D.5.0~5.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com