
��16�֣�ijͬѧ���������˽�����и��������Ե��������Σ������κ�̼���Ρ���ͬѧ����ʵ����֤��һ��ʵ��������в����εĺ������������ϵ�֪���ᣨH2C2O4����һ�ֶ�Ԫ�л����ᣬ���н�ǿ�Ļ�ԭ�ԣ�����ƣ�CaC2O4��������ˮ������ϡ���ᡣ��ش��������⣺
��1����ѧ����������ĥ�ɷ�ĩ����ˮ���ݡ����˵õ�������ҺA����ĥ����ʹ�õ�ʵ������������Ϊ ��
��2�����ʵ�鷽����֤�����к��в����κ�̼���Σ��������Ԥ������ͽ��ۡ�
| ʵ�鲽�� | Ԥ������ͽ��� |
| ����1��������ҺA�������ԣ��μ�����CaCl2��Һ�� | �ٳ��ְ�ɫ������˵�������� �� |
| ����2��ȡ����1�ij������Թ��У�����������ϡ���ᣬ������ȫ�ܽ⣬������������ɫ��ζ������ͨ�����ʯ��ˮ�С� | �� �� |
| ����3������2�õ�����Һ�еμӼ��θ��������Һ�� | �� �� |
��1���в���2�֣���
��2�������ٺ���C2O42����CO32���е�һ�ֻ����ֽ��У�2�֣���
�ڳ���ʯ��ˮ����ǣ�˵�в����к���CO32����2�֣���
�۸��������ɫ��ȥ��˵�������к���C2O42����2�֣���
��3����250ml ����ƿ��2�֣���2MnO4����16H����5C2O42��=2Mn2����10CO2��+8H2O��2�֣�
�� ��10-3��2�֣������������𰸣� ��CD��2�֣�
��10-3��2�֣������������𰸣� ��CD��2�֣�
���������������1��������ĥ�õ�������Ϊ�в�����ĥ����ʹ�õ�ʵ������������Ϊ�в�����2������ƺ�̼��ƾ�Ϊ������ˮ�İ�ɫ���壬����1�г��ְ�ɫ������˵�����������ٺ���C2O42����CO32���е�һ�ֻ����ֽ��У�����2��Ŀ������֤�����к���̼���Σ�ѡ��ϡ�����ܽ�����������ǣ���������1 mol?L-1 HCl��������������ͨ����������ʯ��ˮ�У������dz����ܽ⣬����ʯ��ˮ����ǣ�˵�������к���̼���Σ�����3����Ŀ������֤�����εĴ��ڣ����ò����ξ��л�ԭ�ԣ������ǣ�����2�õ�����Һ�еμӼ���0.01 mol?L-1 KMnO4����������Һ�Ϻ�ɫ��ȥ��˵�������к��в����Σ����Ǣ����ٺ���C2O42����CO32���е�һ�ֻ����ֽ��С��ڳ���ʯ��ˮ����ǣ�˵�в����к���CO32�����۸��������ɫ��ȥ��˵�������к���C2O42������3��������250mL��ҺӦѡ��250mL����ƿ��KMnO4����Һ��C2O42����Ӧ����+2�������ӡ�������̼��ˮ�����ӷ���ʽΪ2MnO4����16H����5C2O42��=2Mn2����10CO2��+8H2O���ڼ��㣺���ݷ�Ӧ����ʽ�ù�ϵʽ��5C2O42-����2KMnO4������������ݼ��㣬�����в����Σ���C2O42�����㣩����������Ϊ ��10-3����������: A��������Һʱδϴ���ձ��Ͳ������ͼ�ˮ���ݣ����������Һ�����ƫС���ⶨ���ƫ�ͣ�����B����ƿδ����ͼ������Һ���еζ����Բⶨ�����Ӱ�죬����C��δ�ñ�Һ��ϴ�ͼ����Һ��ʼ�ζ������������Һ�����ƫ�ⶨ���ƫ�ߣ���ȷ��D���ζ�ǰ���촦�����ݵζ���������ʧ�����������Һ�����ƫ�ⶨ���ƫ�ߣ���ȷ��E���ζ����Ӷ��������������Һ�����ƫС���ⶨ���ƫ�ͣ�����ѡCD��
��10-3����������: A��������Һʱδϴ���ձ��Ͳ������ͼ�ˮ���ݣ����������Һ�����ƫС���ⶨ���ƫ�ͣ�����B����ƿδ����ͼ������Һ���еζ����Բⶨ�����Ӱ�죬����C��δ�ñ�Һ��ϴ�ͼ����Һ��ʼ�ζ������������Һ�����ƫ�ⶨ���ƫ�ߣ���ȷ��D���ζ�ǰ���촦�����ݵζ���������ʧ�����������Һ�����ƫ�ⶨ���ƫ�ߣ���ȷ��E���ζ����Ӷ��������������Һ�����ƫС���ⶨ���ƫ�ͣ�����ѡCD��
���㣺���黯ѧʵ�����������ʵ�鷽������ơ���Һ�����ơ���ϵʽ�����㼰��������


 ���ɿ��õ�Ԫ����AB��ϵ�д�
���ɿ��õ�Ԫ����AB��ϵ�д� С�����ϵ�д�
С�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij����С����Ƴ����ù�ҵ���ᣨ10%H2SO4�����ѽ�ij����������ͭп����Ҫ�ɷݣ�CuO ZnO���ķ�����ʵ�ַ����ۺ����ã���������ͼ��ʾ��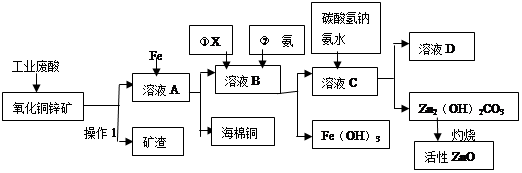
��ش��������⣺
��1������1�������ǣ�
��2������ҺA�м���Fe�۷�������Ҫ�ķ�Ӧ���ӷ���ʽΪ�� �� ��
��3������ҺB�м�������X��Ŀ���� ������X�������������е� ��(����ĸ)
| A��KMnO4 | B��O2 | C��H2O2 | D��NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����ƿ��ǩ�������ɫ����Һ���ֱ���ϡ���ᡢϡ�����ϡ���ᡣ�������ʵ����ʦ������ַ����������ǡ�
| | �� �� �� �� | �� �� �� �� �� |
| ����һ | | |
| ������ | | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��пʪ��ұ�������У����������ͭ��������Ҫ����Zn��Cd��Fe��Cu�ȣ���ֱ�Ӷ�������ɻ�����Ⱦ��Ҳ����Դ�˷ѣ�����Ϊ���մ���ͭ�����Ʊ�����п����Ĺ�ҵ���̣�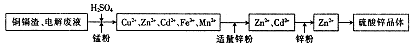
��֪������п����������ˮ�������ھƾ���
��1�����������Ŀ�� ��
��2��������ܳ�ͭ�������̷���Ϊ�˽�������ӵı�������ݵ��ӣ���ͭ�ܳ����̷۵���Ҫ�ɷ�ΪMnO2����ط���ʽΪ2Fe3++Cu=2Fe2++Cu2+�� ��
��3��������п��Һ�������п���壬��Ҫ�IJ�������Ϊ ��
��4���Ƶõ�����п������Ҫϴ�ӣ�ѡ����Լ�Ϊ ��ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��ҵ�ϳ����õ�Ʒλ���̿�(��Ҫ�ɷ���MnO2)�����պ�SO2�ķ����������Ƶ������̾���(MnSO4��H2O)������Ҫ�������£�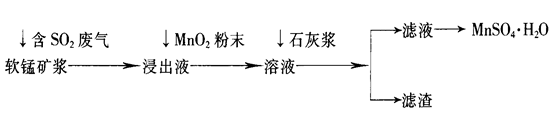
��֪������Һ��pH��2�����еĽ���������Ҫ��Mn2+��������������Fe2+��Al3+�������������ӡ��йؽ��������γ������������ʱ��Һ��pH���±���
| ���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
���������Ҫ�ɷֿɱ�ʾΪFeO��Cr2O3��������MgO��Al2O3��Fe2O3�����ʣ��������Ը�����Ϊԭ���Ʊ��ظ���أ�K2Cr2O7��������ͼ��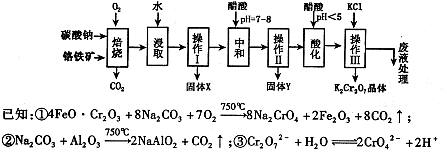
��������ش��������⣺
��1������X����Ҫ���� ����д��ѧʽ����Ҫ����ữ��������Һ��pH�Ƿ����4��5��Ӧ��ʹ�� ����д�������Լ����ƣ���
��2���ữ�����ô��������ҺpH <5����Ŀ���� ��
��3���������жಽ��ɣ����K2Cr2O7����IJ��������ǣ�����KCl���塢����Ũ����
�����ˡ� �����
��4���±���������ʵ��ܽ�����ݣ�����III������Ӧ�Ļ�ѧ����ʽ��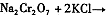
 ���÷�Ӧ����Һ���ܷ����������ǣ� ��
���÷�Ӧ����Һ���ܷ����������ǣ� ��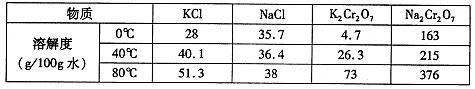
��5������ƷY��Ҫ��������������������þ���������ܻ����P���������ʣ���ȷ����Y���������������ķ����dz�ȡng��Ʒ��������� ����д�Լ������ܽ⡢���ˡ��ټ������ ����д�Լ������������ա���ȴ���������ø������mg��������Ʒ��������������������Ϊ ���ú�m��n�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
(6�֣�A��B��C��D���ֿ����Ի�����ֱ���������Fe3+��Ba2+��Al3+��Na+��������OH-��SO42-��Cl-��CO32-�еĸ�һ����ɣ����Ӳ��ظ�����ͨ��ʵ�飬�ó����½��ۣ�
��A��D����Һ�Լ��ԣ�0��1mol��L-1A��Һ��pHС��13��
��ͭ�����ܽ���B����Һ�У�
����C����Һ�м��������D��Һ������û�г�����
��������ʵ����ʵ���ش��������⣺
��1�� ��д��A��B�Ļ�ѧʽ��A ��B___________��
��2�� ��д��ʵ����з�Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
��17�֣���2012?�㶫��������㷺Ӧ������ҩ�ͻ�����ҵ��ijͬѧ�����üױ���������Ӧ�Ʊ������ᣬ��Ӧԭ����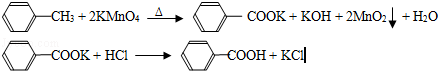
ʵ�鷽����һ�����ļױ���KMnO4��Һ��100�淴Ӧһ��ʱ���ֹͣ��Ӧ�����������̷����������ͻ���δ��Ӧ�ļױ���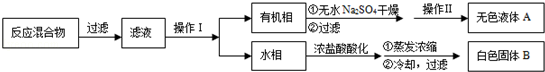
��֪�������������122���۵�122.4�棬��25���95��ʱ�ܽ�ȷֱ�Ϊ0.3g��6.9g�����������л��ﶼ�й̶��۵㣮
��1���������� ������������ ����
��2����ɫҺ��A���� �������Լ���A���Լ����� ������������
��3���ⶨ��ɫ����B���۵㣬��������115�濪ʼ�ۻ����ﵽ130��ʱ�����������ۣ���ͬѧ�Ʋ��ɫ����B�DZ�������KCl�Ļ�����������·��������ᴿ�ͼ��飬ʵ���������Ʋ���ȷ�����ڴ������ɱ������ݣ�
| ��� | ʵ�鷽�� | ʵ������ | ���� |
| �� | ����ɫ����B����ˮ�У������ܽ⣬��_________�� ��_________�� | �õ���ɫ�������ɫ��Һ | |
| �� | ȡ������Һ���Թ��У���_________�� | ���ɰ�ɫ���� | ��Һ��Cl�� |
| �� | �����ɫ���壬��_________�� | ��_________�� | ��ɫ�����DZ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
������㷺Ӧ������ҩ�ͻ�����ҵ��ij��ȤС��ͬѧ���ø�����������ױ��Ʊ�������(KMnO4���������»�ԭ����ΪMnO2������������ΪMn2+)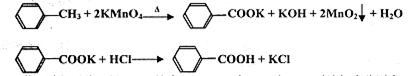
��֪����������Է�����122���۵�122.4�棬��25���95��ʱ�ܽ�ȷֱ�Ϊ0.3 g��6.9 go��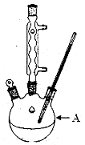
ʵ�����̣�
����װ��A�м���2.7mL (2.3 g)�ױ���125 mLˮ��Ȼ������μ���8.5 g�Թ�����KMnO4���壬���Ʒ�Ӧ�¶�Լ��100�棬���ױ��������ʧ���������ٳ�������ʱ��ֹͣ���ȡ�
�ڽ���Ӧ�������ȹ��ˣ���������ˮϴ���������ϲ���Һ��ϴ��Һ����ȴ�����Ũ���ᣬ������I�ð�ɫ�ϸ���ֲ�Ʒ��
�۴��Ȳⶨ����ȡ1.220g��ɫ��Ʒ�����100mL���״���Һ��ȡ25.00mL��Һ����0.1000mol/L KOH����Һ�ζ����ظ��ζ��ĴΣ�ÿ�����ĵ�������±���ʾ�о�
��ش�
��1��װ��A������ ���������¶ȼƣ���ʵ����Ʒ�Ӧ�¶ȵĴ�ʩΪ ��
��2����ɫ�ֲ�Ʒ�г���KCl�⣬�������ܵ�������Ϊ____ ��
��3������I������ ��
��4����������õ��Ķ��������� ��100mL����ƿ��50mL��ʽ����ʽ�ζ��ܡ�
��5����Ʒ�б����ᴿ��Ϊ ��
��6���ζ������У������װ��KOH����Һ�ĵζ��ܶ���ʱ���ζ�ǰ���ӣ��ζ�������ⶨ��� (�ƫ����ƫС�����䡱)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com