
工业上常利用低品位软锰矿浆(主要成分是MnO2)来吸收含SO2的废气,最终制得硫酸锰晶体(MnSO4·H2O),其主要流程如下: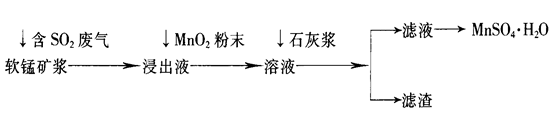
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(12分,每空2分)(1)SO2+MnO2=MnSO4
(2)将Fe2+氧化为Fe3+;2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
(3)使Fe3+、Al3+完全沉淀;4.7≤pH<8.3 (4)Fe(OH)3、Al(OH)3、CaSO4
解析试题分析:(1)低品位软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,这说明MnO2与SO2发生了氧化还原反应,反应的化学方程式为SO2+MnO2=MnSO4。
(2)杂质离子中Fe2+完全沉淀时的pH大于Mn2+开始沉淀时的pH,所以必须利用其还原性将其氧化成铁离子而除去。由于MnO2具有氧化性,能把亚铁离子氧化生成Fe3+,有关反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。
(3)溶液的杂质离子Fe3+、Al3+阳离子,从图可表以看出,大于4.7可以将Fe3+和Al3+除去,但不能超过8.3,以防止Mn2+也沉淀,所以只要调节pH值在4.7≤pH<8.3间即可。
(4)Fe3+、Al3+等金属阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,同时还生成微溶性的硫酸钙,所以滤渣主要有氢氧化铁、氢氧化铝、硫酸钙,其化学式分别是Fe(OH)3、Al(OH)3、CaSO4。
考点:考查氧化还原反应方程式的书写、物质的除杂、反应条件的控制以及生成物的判断等


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: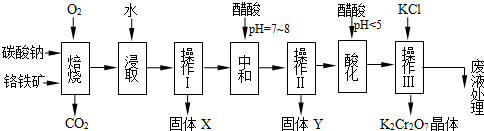
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2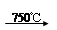 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3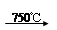 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+
(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
 ), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。
), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg,流程如下图所示: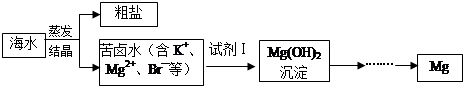
(1)工业制取镁的方法是 法。
(2)试剂Ⅰ一般选用 (填化学式)。
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。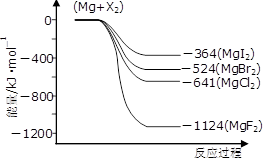
①由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应;推测化合物的热稳定性顺序为MgI2 MgF2(填“>”、“=”或“<”)。
②依上图数据写出MgBr2(s)与Cl2(g)反应的热化学方程式 。
(4)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体生成。写出CH3MgCl水解的化学方程式 。
(5)向Mg(OH)2中加入NH4Cl溶液,可使沉淀溶解,请结合平衡原理和必要的文字解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下图:
(1)电解精练银时,阴极反应式为_______________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该红棕色气体与水反应的化学方程式为_______________________________________。
(2)固体混合物B的组成为_____________;在生成固体B的过程中,必须控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为_____________________。
(3)煅烧过程中生成的氧化产物与NH3在催化剂条件下反应的化学方程式为_____________________。这个反应中会有白烟产生,该白烟为______________。
(4)若银铜合金中铜的质量分数为64%,理论上3.0kg废料中的铜可完全转化为__________molCuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液___________L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用粉碎的煤矸石(主要含Al2O3、SiO2及铁的氧化物)制备净水剂BAC〔Al2(OH)nCl6-n〕的流程如下: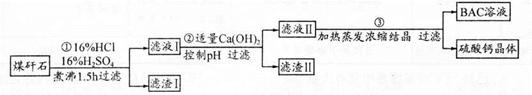
(1)粉碎煤矸石的目的是______;滤渣I的主要成分是______ (填化学式)。
(2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中有色离子为______(填化学式);随后溶液又变为棕黄色,相关离子反应方程式为______;
步骤①的煮沸装置上方需安装一长导管,长导管的作用是____________。
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是___________;巳知BAC的分散质粒子大小在1 nm?100 nm之间,由此区别滤液I与BAC两种液体的物理方法是______;若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的离子方程式______。
(4)若0.1 molAlCl3在某温度下溶于蒸馏水,当有5℅水解生成Al(OH)3溶液时,吸收热量a kJ。写出该过程的热化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(16分)某同学从网络上了解到菠菜中富含可溶性的两类正盐:草酸盐和碳酸盐。该同学欲用实验验证这一事实并检测其中草酸盐的含量。查阅资料得知草酸(H2C2O4)是一种二元有机弱酸,具有较强的还原性;草酸钙(CaC2O4)不溶于水能溶于稀硫酸。请回答下列问题:
(1)该学生将菠菜研磨成粉末、热水浸泡、过滤得到澄清溶液A。研磨菠菜使用的实验仪器的名称为 。
(2)设计实验方案验证菠菜中含有草酸盐和碳酸盐,补充完成预期现象和结论。
| 实验步骤 | 预期现象和结论 |
| 步骤1:调节溶液A至弱碱性,滴加足量CaCl2溶液。 | ①出现白色沉淀,说明菠菜中 。 |
| 步骤2:取步骤1的沉淀于试管中,加入足量的稀硫酸,沉淀完全溶解,并将产生的无色无味的气体通入澄清石灰水中。 | ② 。 |
| 步骤3:向步骤2得到的溶液中滴加几滴高锰酸钾溶液。 | ③ 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)1,2 -二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2 -二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。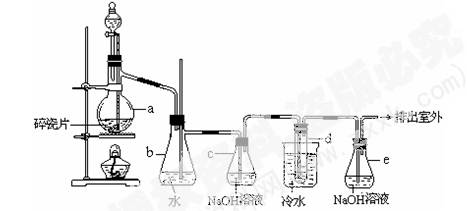
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式。_ ;_____________________。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:____________________________________________。
(3)容器c中NaOH溶液的作用是:________________________________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因: ______________, _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)氯化钾样品中含有少碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将过滤液按下图所示步骤进行操作。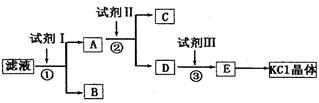
回答下列问题:
(1)起始时滤液的pH_____7(填“大于”“小于”或“等于”),其原因是__________________(用离子方程式表示)。
(2)试剂I的化学式为______,①中发生反应的离子方程式为_____________________。
(3)试剂II的化学式为_____,②中加入试剂II的目的是_________________________。
(4)试剂III的名称是_____,③中发生反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知木炭在一定条件下与浓硝酸反应生成两种+4价的氧化物,为了探究一氧化氮(NO)能否与过氧化钠反应,以及反应后的产物中是否有亚硝酸钠(NaNO2),某小组同学设计了如图所示装置(夹持仪器和连接用的胶管已经省略)。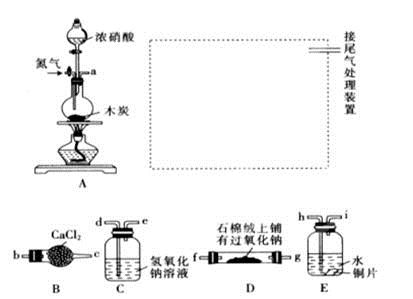
(1)为了完成该实验,虚线框内还需要连接B~E四套装置,按气流方向连接的顺序为:
a→( )( )→( )( )→( )( )→ ( )( )(填仪器接口的字母编号)。连接好仪器,检查气密性,装入药品后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯,通入氮气的主要目的是 。
(2)装置E中观察到的主要实验现象有 。
(3)装置C的作用是 。
(4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解生成一氧化氮。装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成: 。(写出检验步骤及现象)。
(5)亚硝酸钠在酸性条件下可将I-氧化为I2,同时生成NO,该反应常用于亚硝酸钠含量的测定,请写出该反应的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com