
海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg,流程如下图所示: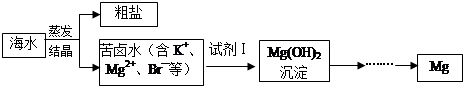
(1)工业制取镁的方法是 法。
(2)试剂Ⅰ一般选用 (填化学式)。
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。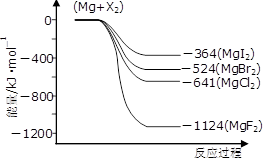
①由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应;推测化合物的热稳定性顺序为MgI2 MgF2(填“>”、“=”或“<”)。
②依上图数据写出MgBr2(s)与Cl2(g)反应的热化学方程式 。
(4)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体生成。写出CH3MgCl水解的化学方程式 。
(5)向Mg(OH)2中加入NH4Cl溶液,可使沉淀溶解,请结合平衡原理和必要的文字解释原因 。
(1)电解法或电解熔融氯化镁
(2)Ca(OH)2(该空1分) (3)①放热(该空1分),<
②MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l) △H=-117KJ·mol—1
(4)CH3MgCl+H2O=CH4↑+Mg(OH)Cl↓或2CH3MgCl+2H2O=2CH4↑+Mg(OH)2↓+MgCl2
(5)Mg(OH)2(s) Mg2+(aq)+2OH¯(aq),向Mg(OH)2中加入NH4Cl溶液后,铵根离子结合氢氧根离子生成一水合氨,降低了氢氧根离子浓度,使氢氧化镁沉淀的溶解平衡向右移动,从而沉淀溶解。
Mg2+(aq)+2OH¯(aq),向Mg(OH)2中加入NH4Cl溶液后,铵根离子结合氢氧根离子生成一水合氨,降低了氢氧根离子浓度,使氢氧化镁沉淀的溶解平衡向右移动,从而沉淀溶解。
解析试题分析:(1)镁是活泼的金属,工业制取镁的方法是电解熔融的氧化镁,即电解法冶炼镁。
(2)要将溶液中的Mg2+转化为氢氧化镁沉淀,需要加入碱。考虑试剂的来源和经济效益,一般加入的是氢氧化钙,化学式为Ca(OH)2。
(3)①由图可知反应物的总能量均高于生成物的总能量,所以Mg与卤素单质的反应均为放热反应。镁与单质氟反应放出的热量最多,则生成的MgF2稳定性最强,所以化合物的热稳定性顺序为MgI2<MgF2。
②根据图像可知,Mg(s)+Cl2(g)=MgCl2(s) △H=-641kJ/mol、Mg(s)+Br2(l)=MgBr2(s) △H=-524kJ/mol,则根据盖斯定律可知,前者减去后者即得到反应MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l),所以该反应的反应热△H=-641kJ/mol+524kJ/mol=-117KJ/mol。
(4)CH3MgCl易与水发生水解反应并有无色无味气体生成,则该气体应该是甲烷。所以根据原子守恒可知,另外的生成物是碱式氯化镁,因此CH3MgCl水解的化学方程式为CH3MgCl+H2O=CH4↑+Mg(OH)Cl↓或2CH3MgCl+2H2O=2CH4↑+Mg(OH)2↓+MgCl2。
(5)氢氧化镁溶于水存在溶解平衡Mg(OH)2(s) Mg2+(aq)+2OH¯(aq),铵根离子结合氢氧根离子生成一水合氨,降低了氢氧根离子浓度,使氢氧化镁沉淀的溶解平衡向右移动,沉淀溶解。
Mg2+(aq)+2OH¯(aq),铵根离子结合氢氧根离子生成一水合氨,降低了氢氧根离子浓度,使氢氧化镁沉淀的溶解平衡向右移动,沉淀溶解。
考点:考查金属镁的冶炼、试剂的性选择、物质稳定性判断、热化学方程式的书写、水解应用以及外界条件对溶解平衡的影响


科目:高中化学 来源: 题型:填空题
用霞石岩(化学式为 KNa3[AlSiO4]4,主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:
已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度见右图。
试回答下列问题:
(1)灼烧得到固体M的化学方程式是________________________________。
(2)X物质是___________,滤液W中主要含有的离子有____________。(写三种)
(3)操作Ⅰ得到碳酸钠晶体的操作为 、 、 、洗涤、干燥。
(4)碳酸化Ⅰ中发生主要反应的离子方程式是__________________________。
(5)碳酸化Ⅱ调整pH=8的目的是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下: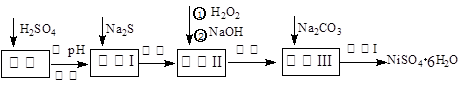
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式__________ __________
(2) 加6%的H2O2时,温度不能过高,是因为: _____ ________ 。
(3) 除铁方法:用H2O2充分氧化后,再用NaOH控制pH值3~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为:___________________________________________________________________________
(4)上述流程中滤液Ⅲ的主要成分是: 。(填化学式)
(5)操作Ⅰ包括以下过程:过滤,用 (填试剂化学式)溶解, ,洗涤获得产品。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,可证明滤液中含Na+,不含K+。
由上述现象推断:
(1)该混合物中一定含有 ;一定不含有 ,可能含有 。
(2)如要对可能含有的物质进行检验,如何操作:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
(1)图中的两处明显的错误是:________________________ ;_________________________________。
(2)B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,还需加入少量_______,其作用是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有三瓶标签脱落的无色透明溶液,分别是稀盐酸、稀硫酸和稀硝酸。请你帮助实验老师设计两种方法鉴别它们。
| | 操 作 步 骤 | 现 象 及 结 论 |
| 方法一 | | |
| 方法二 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
磷酸铁锂(LiFePO4)被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下: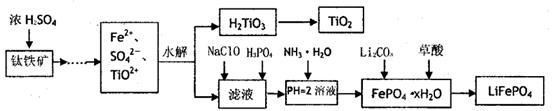
已知:H2LiO3是种难溶于水的物质。
(1)钛铁矿用浓硫酸处理之前,需要粉碎,其目的
(2)TiO2+水解生成H2TiO3的离子方程式
(3)加入NaClO发生反应的离子方程式
(4)在实验中,从溶液中过滤出H2TiO3后,所得滤液浑浊,应如何操作 。
(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁己全部转化为二价铁离子),采取KMnO4标准液漓定Fe2+的方法:(不考虑KMnO4与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果 。 (填“偏高、偏低、无影响”),滴定终点的现象 。滴定分析时,称取a g钛铁矿,处理后,用cmol/LKMnO4标准液滴定,消耗VmL,则铁元素的质量分数的表达式为
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
工业上常利用低品位软锰矿浆(主要成分是MnO2)来吸收含SO2的废气,最终制得硫酸锰晶体(MnSO4·H2O),其主要流程如下: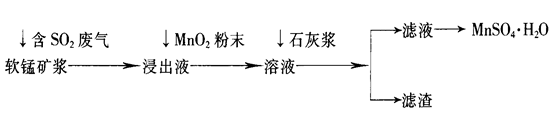
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氮化铝(AlN)是一种新型无机材料。某氮化铝(AlN)仅含有Al2O3杂质,某学习小组为测定该氮化铝样品中AlN的纯度,查阅资料得知:AlN + NaOH + 3H2O = Na[Al(OH)4] + NH3↑。设计如下2种方案。
方案一:量气法——如图所示。
(1)按图连接好装置,检查装置气密性的方法是 。
(2) 导管a的主要作用是 。
(3)为测定生成气体的体积,量气装置中的X液体可以是: 。(填标号)
| A.CCl4 | B.H2O | C.NH4Cl溶液 | D.植物油 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com