
用霞石岩(化学式为 KNa3[AlSiO4]4,主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:
已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度见右图。
试回答下列问题:
(1)灼烧得到固体M的化学方程式是________________________________。
(2)X物质是___________,滤液W中主要含有的离子有____________。(写三种)
(3)操作Ⅰ得到碳酸钠晶体的操作为 、 、 、洗涤、干燥。
(4)碳酸化Ⅰ中发生主要反应的离子方程式是__________________________。
(5)碳酸化Ⅱ调整pH=8的目的是_______________________________。
(1)2Al(OH)3 Al2O3+ 3H2O (3分)
Al2O3+ 3H2O (3分)
(2)CO2或二氧化碳(2分) Na+、K+、HCO3? (3分,各1分,错写、多写每个倒扣1分至0分)
(3)蒸发浓缩、冷却结晶、过滤(3分,各1分)
(4)2AlO2? + CO2 + 3H2O =2Al(OH)3↓+ CO32?(3分,产物写成HCO3—给0分)
(5)碳酸根转化为碳酸氢根离子(1分),利于KHCO3结晶析出(1分)
解析试题分析:(1)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO2气体。溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中,所以通入CO2后一定生成氢氧化铝沉淀,灼烧则得到氧化铝,即M是氧化铝,所以灼烧得到固体M的化学方程式是2Al(OH)3 Al2O3+ 3H2O。
Al2O3+ 3H2O。
(2)物质X是二氧化碳,滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na+、K+、HCO3-。
(3)碳酸化Ⅰ的目的是制备氢氧化铝,又因为溶液的pH=11,所以生成的是碳酸盐,而不是碳酸氢盐,即该反应的离子方程式应该是2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32-,故答案为:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32-;
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥即可。
(5)已知NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO2? + CO2 + 3H2O =2Al(OH)3↓+ CO32?。
(6)由于NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出。
考点:考查物质的分离与提纯、实验设计与探究


科目:高中化学 来源: 题型:填空题
军用光敏材料KxFe(C2O4)y·3H2O(Fe为+3价)的实验室制备和测定其组成的方法如下所示:
Ⅰ.制备:
(1)用K2C2O4和FeCl3制备光敏材料的反应属于________(填序号)。
①离子反应 ②非氧化还原反应 ③氧化还原反应 ④化合反应
(2)结晶时应将饱和溶液放在黑暗处等待晶体的析出,这样操作的原因是_________。
(3)操作4的实验操作有____________。
Ⅱ.组成测定:
称取一定质量实验所得的晶体置于锥形瓶中,加足量蒸馏水和稀H2SO4,将C2O42-完全转化为H2C2O4,用0.10 mol·L-1 KMnO4溶液进行滴定,消耗KMnO4溶液24.00 mL时恰好完全反应(酸性条件下MnO4-的还原产物是Mn2+);再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00 mL。
(4)高锰酸钾氧化H2C2O4和Fe2+的离子方程式分别是___________; ________。
(5)配制100 mL 0.10 mol·L-1 KMnO4溶液及在上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外,还有________和________(写名称)。
(6)通过计算,该化合物的化学式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高纯超微细草酸亚铁可用于合成新型锂电池电极材料,工业上可利用提取钛白粉的副产品绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+2NH3·H2O=Fe(OH)2↓+(NH4)2SO4
Fe(OH)2+H2C2O4=FeC2O4+2H2O
(1)绿矾中含有一定量的TiOSO4杂质。将绿矾溶于稀硫酸,加入铁粉、搅拌、充分反应并保持一段时间,过滤,可得纯净的FeSO4溶液。在上述过程中,TiOSO4能与水反应转化为H2TiO3沉淀,写出该反应的化学方程式: ;加入铁粉的作用有 、 。
(2)由纯净的FeSO4溶液制取FeC2O4时,需在真空环境下进行,原因是 。
FeC2O4生成后,为提高产品纯度,还需调节溶液pH=2,若pH过低,则导致
FeC2O4的产率 (填“偏高”、“偏低”或“无影响”)。
(3)将含有FeC2O4的混合液过滤,将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是 、 。
(4)某研究小组欲从某化工残渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备较纯净的FeSO4溶液,再合成FeC2O4。请补充完整由该化工残渣制备较纯净的FeSO4溶液的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量该化工残渣中加入足量的稀硫酸充分反应,过滤, ,过滤,得到较纯净的FeSO4溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验: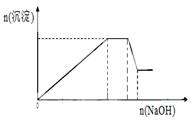
第一步:加入过量的稀盐酸,无沉淀生成。
第二步:继续加入过量的稀硫酸,有白色沉淀生成。
第三步:过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,
在此过程中溶液沉淀量的变化如右图所示,加热该溶液,
可产生使湿润的红色石蕊试纸变蓝色的气体。
根据以上实验现象回答下列问题:
(1)该待测液中一定含有 离子,一定没有 离子,可能有 离子。
(2)某同学采用测pH的方法来判断滴入NaOH溶液后是否使溶液呈碱性,该实验操作是 。
(3)第三步中产生使湿润红色石蕊试纸变蓝色的气体的离子方程式为 ,该步骤中预
期会出现另外一个特殊的实验现象,该现象对应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
完成下列填空:
(1)氯碱工业主要以食盐为原料。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列操作,正确的操作顺序是 。
①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑤加过量的BaCl2溶液
a.②⑤④①③ b.①④②⑤③ c d.⑤②④①③
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是________________,所用主要仪器的名称是____________________。
(3)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是 。
(4)步骤II反应的离子方程式__________________________________________。
(5)海水提溴蒸馏过程中,温度应控制在80~90℃,温度过高或过低都不利于生产 ,请解释原因 。
(6)Mg(OH)2沉淀中混有Ca(OH)2,可选用__________溶液进行洗涤除去。如直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,你_______(选填“同意”,“不同意”)该说法,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422 ℃,沸点1366 ℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
(1)在粗盐除杂的反应I中加Na2CO3溶液的作用是 ;
滤渣的主要成分: 。
(2)反应Ⅱ完成后溶液中主要溶质是 。
(3)反应IV和VI都是制备CuCl的化学过程:
①反应IV加入的Cu必须过量,其目的是 。
②写出反应VI的离子方程式 。
(4)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS),共同生产MnO2和Zn(干电池原料)。
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②IV中的电解反应式为MnSO4+ZnSO4+2H2O  MnO2+Zn+2H2SO4。
MnO2+Zn+2H2SO4。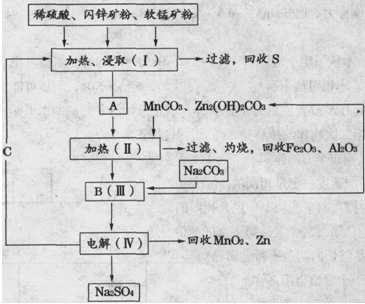
(1)A中属于还原产物的是 。
(2)MnCO3、Zn2(OH)2CO3的作用是 ;Ⅱ需要加热的原因是 ;C的化学式是 。
(3)Ⅲ中发生的离子方程式为 , ;
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: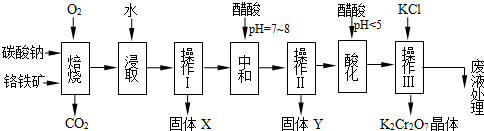
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3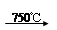 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+
(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
 ), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。
), 该反应可用来检验Cr2O72-的存在。写出反应的离子方程式: 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg,流程如下图所示: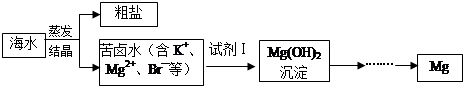
(1)工业制取镁的方法是 法。
(2)试剂Ⅰ一般选用 (填化学式)。
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。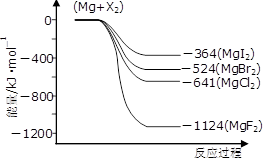
①由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应;推测化合物的热稳定性顺序为MgI2 MgF2(填“>”、“=”或“<”)。
②依上图数据写出MgBr2(s)与Cl2(g)反应的热化学方程式 。
(4)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体生成。写出CH3MgCl水解的化学方程式 。
(5)向Mg(OH)2中加入NH4Cl溶液,可使沉淀溶解,请结合平衡原理和必要的文字解释原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com