
【题目】二氧化硫常温下为无色有刺激性气味的有毒气体,易液化,易溶于水。某同学设计如下实验方案,对二氧化硫的化学性质进行探究,装置如下图所示。请回答下列问题:
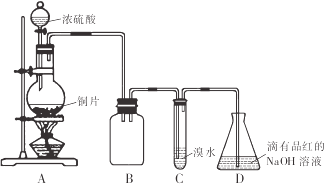
(1)反应结束时烧瓶中Cu由剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量。经冷却,定量稀释后进行下列实验,能达到的目的是 (填序号)
a.用酸碱中和滴定法测定
b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液PH值
d.与足量BaCl2溶液反应,称量生成沉淀的质量
(2)装置B的作用是 ,设计装置C的目的是验证SO2的 性,装置C中发生反应的离子方程式 ,装置D中NaOH全部转化为NaHSO3的标志是____________
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能情况:
I.HSO3-与ClO-刚好反应完; Ⅱ.NaClO不足; Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:(已知酸性:H2SO3>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 加入几小块CaCO3固体 | 有气泡产生 | |
② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
③ | 滴加少量溴水,振荡 | Ⅱ | |
④ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液为紫色 |
【答案】
(1)bc(2分)
(2)防倒吸(或安全瓶);还原;SO2+Br2+2H2O=4H++SO42-+2Br-;溶液由红色变为无色;(4分)
(3)(4分)
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | Ⅰ或Ⅱ | ||
② | 溶液变为蓝色 | ||
③ | 溴水褪色 | ||
④ | Ⅰ或Ⅲ |
【解析】由图可知,A中发生Cu与浓硫酸的反应生成二氧化硫,B作安全瓶,可防止倒吸,C中发生SO2+Br2+2H2O=H2SO4+2HBr,D中NaOH溶液吸收尾气。
(1)某同学认为H2SO4也有剩余,则可以检验H+或测定稀硫酸的pH确定稀硫酸的存在;烧瓶中存在硫酸铜和硫酸,若用中和滴定法其中的硫酸铜也会消耗碱,达不到目的;同理加入足量的氯化钡,其中的硫酸铜也会消耗氯化钡,同样不能达到目的。故答案为:b c;
(2)装置B的作用是防倒吸(或安全瓶),C中发生的反应中S元素的化合价升高,则设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-。装置D中NaOH全部转化为NaHSO3时碱性降低,装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色,故答案为:防倒吸(或安全瓶);还原;SO2+Br2+2H2O=4H++SO42-+2Br-;溶液由红色变为无色;
(3)①加入几小块CaCO3固体,生成CO2气体,溶液显酸性,可能是Ⅰ或Ⅱ;②如果你漂白粉过量,发生反应NaHSO3+Ca(ClO)2═CaSO4↓+NaCl+HClO,次氯酸氧化碘离子为碘单质,碘遇淀粉变蓝,溶液变为蓝色;③如果你漂白粉不足,溴水被NaHSO3溶液还原,溴水褪色;④如果HSO3-与ClO-刚好反应完,方程式为2NaHSO3+Ca(ClO)2+CaCl2═2CaSO4↓+2NaCl+2HCl,滴入加少量酸性KMnO4溶液,溶液显紫色,说明没有还原性物质,反应可能是Ⅰ或Ⅲ;故答案为:①Ⅰ或Ⅱ;②溶液变为蓝色;③溶液褪色;④Ⅰ或Ⅲ;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
B.标准状况下,22.4LH2O含有的分子数为 NA
C.通常状况下,NA 个CO2分子占有的体积为22.4L
D.物质的量为0.5 mol的MgCl2中,含有Mg2+个数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解的离子方程式正确的是( )
A.S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B.AlO2一+2H2O![]() Al(OH)3+OH-
Al(OH)3+OH-
C.CO32-+H2O=HCO3-+OH-
D.Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
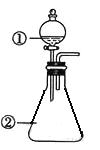
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10mL浓度为1mol·L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是( )
A.KNO3 B.CH3COONa C.CuSO4 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯气的叙述,不正确的是( )
A. 氯气是一种有毒的气体 B. 氯气、氯水、液氯是同一种物质
C. 氯气能与水发生反应 D. 氯气是一种黄绿色,有刺激性气味的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:H+ + HCO3- ![]() H2CO3
H2CO3 ![]() CO2 + H2O。故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是( )
CO2 + H2O。故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是( )
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人在静脉滴注大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH略减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物种类繁多的原因,不正确的是( )
A. 碳原子有四个价电子
B. 碳原子彼此可结合成长链或各种环状
C. 组成有机物的元素种类很多
D. 有机物容易形成同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com