
【题目】短周期中的四种主族元素A、B、C、D、E,原子序数依次增大。A是电负性最大的元素,B、D的价电子层中均有两个未成对电子,回答下列问题:
(1)B元素在周期表中的位置为___________________________;
(2)A的基态原子中,电子占据的最高能级符号为___;该能级的电子云轮廓图形状为__________;
(3)B、C、D三种元素的第一电离能大小顺序为________;该电离能大小变化的原因为________________;
(4)C、D、E三种元素的最高价氧化物的水化物的酸性强弱顺为________________。
【答案】第三周期ⅣA族 2p 哑铃形(纺锤形) Si<S<P S与Si相比较,S半径小,核电荷数大,S原子对电子吸引能力更强,因此第一电离能S>Si;而P原子的2p能级为半充满,较稳定,较难失去第一个电子,因此第一电离能P>S HClO4>H2SO4>H3PO4
【解析】
短周期中的四种主族元素,原子序数依次增大。A是电负性最大的元素,A是F;B、D的价电子层中均有两个未成对电子, B是Si,D是S; C介于Si和S之间,是P;短周期中的四种主族元素原子序数依次增大,则E是Cl。
(1)B是Si,14号元素,第三周期ⅣA族
(2)氟原子的电子排布图![]() ,电子占据的最高能级符号为2p,该能级的电子云轮廓图形状为哑铃形(纺锤形);
,电子占据的最高能级符号为2p,该能级的电子云轮廓图形状为哑铃形(纺锤形);
(3)S与Si相比较,S半径小,核电荷数大,S原子对电子吸引能力更强,因此第一电离能S>Si;而P原子的2p能级为半充满,较稳定,较难失去第一个电子,因此第一电离能P>S>Si
(4)元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P,Cl、S、P三种元素的最高价氧化物的水化物分别为H3PO4、H2SO4 、HClO4,所以其最高价氧化物的水化物的酸性强弱顺序为HClO4>H2SO4>H3PO4。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平。现以A为主要原料合成乙酸乙酯,其合成路线如下,回答下列问题:
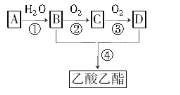
⑴写出A、C的名称________、_________。
⑵B、D分子中的官能团化学式分别是__________、__________。
⑶写出下列反应的反应类型:
①______________,④____________。
⑷写出下列反应的化学方程式:
①__________________;
②__________________;
③___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65 g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
A.196.64 kJB.196.64 kJ/molC.<196.64 kJD.>196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
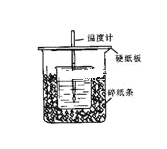
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___。
(2)烧杯间填满碎纸条的作用是___。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___(填“偏大、偏小、无影响”)。
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等、不相等”),所求中和热___(填“相等、不相等”)。
(5)用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会___;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)①铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是___ (填字母)。
A. 电子从基态跃迁到较高的激发态 B. 电子从较高的激发态跃迁到基态
C. 焰色反应的光谱属于吸收光谱 D. 焰色反应的光谱属于发射光谱
②碘、铜两种元素的电负性如表:
元素 | I | Cu |
电负性 | 2.5 | 1.9 |
CuI属于_______(填“共价”或“离子”)化合物。
(2)氯化铁溶液用于检验食用香精乙酰乙酯时,会生成紫色配合物,其配离子结构如图所示。
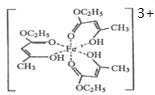
①此配合物中,基态铁离子的价电子排布图为________________。
②此配合物中碳原子的杂化轨道类型有________________。
③此配离子中含有的化学键有____________(填字母)。
A.σ键 B.π键 C.极性键 D.非极性键 E. 配位键 F. 氢键 G.离子键
(3)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是_____________。
(4)治疗铅中毒可滴注依地酸(别名EDTA,结构如下面左图)钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_________(填标号)
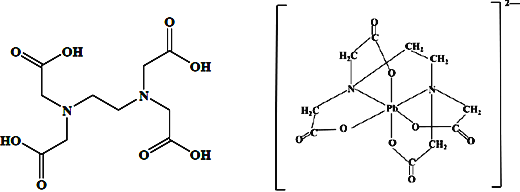
A.形成依地酸铅离子所需n(Pb2+):n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
(5)AlCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态还是气态,一个分子中的氯原子与另外一个铝原子形成配位键,因此以二聚体Al2Cl6的形式存在,写出Al2Cl6的结构式_______(用→标出配位键)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4A+2B![]() 3C,下列说法中正确的是
3C,下列说法中正确的是
A. 某温度时,化学反应速率无论用A. B. C中任何物质表示,其数值都相同
B. 其他条件不变时,降低温度,化学反应速率减小
C. 其他条件不变时,增大压强,化学反应速率一定加快
D. 若增大或减小A的物质的量,化学反应速率一定会发生明显的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点

(1)在100℃时,Kw表达式为_______,在此温度下,kw为___.
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7则Ba(OH)2与盐酸的体积比为____.
(3)室温时将PH为3的硫酸溶液稀释100倍,稀释后溶液中,C(SO42-)和C(H+)之比约为___.
II.今有①CH3COOH ②HCl ③H2SO4三种溶液.根据要求回答下列问题:
(1)写出①的电离方程式_______.
(2)当它们pH相同时,其物质的量浓度最大的是___(填序号).
(3)当它们的物质的量浓度相同时,其pH最小是___(填序号).
(4)在室温下,将c(H+)均为0.01mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为___(填序号).
(5)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为____.
(6)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为___(填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵盐在工农业生产中有着重要的用途,请根据要求完成下列各题。
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。
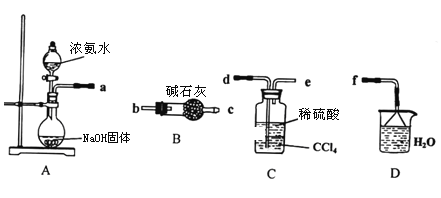
(1)仪器连接的顺序(用接口序号字母表示)是:a_________________
(2)将装置C中两种液体分离开的操作名称是________________。
(3) (NH4)2SO4“低毒,有刺激性,有吸湿性、吸湿后固结成块”。储存应注意_________________。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:

请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为___________________________。
(2)由MgCl2溶液蒸发得到MgCl2·6H2O晶体,蒸发的目的是_________。
a.得到热饱和溶液 b.析出晶体
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:__________________________________。
②由MgCl2·6H2O制备无水MgCl2的操作在______________氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com