
[化学—选修物质结构和性质](15分)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2∶1。请回答下列问题:
(1)A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于 (填写“六方”、“面心立方”或“体心立方”)。
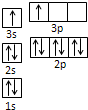
(2)B-的电子排布式为 ,在CB3分子中C元素原子的原子轨道发生的是 杂化。
(3)C的氢化物的空间构型为 ,其氢化物在同族元素所形成的氢化物中沸点最高的原因是 。
(4)B元素的电负性 D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱: 。
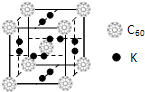
(5)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。试计算R晶体的密度为 。(阿伏加德罗常数用NA表示)
26.(1)体心立方(2)ls22s22p63s23p6,sp3(3)三角锥形;氨分子间形成氢键,所以氨气比同族其它元素形成的氢化物沸点高(4)>;H2S+Cl2=2HCl+S↓ (5)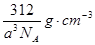
解析试题分析:根据题目信息可知A为钠B为氯,C为氮D为硫.
1、钠形成的晶体属于体心立方,
2、氯离子有18个电子,可以写出其电子排布式为ls22s22p63s23p6,CB3分子为三氯化氮分子,C元素原子的原子轨道发生的是sp3
3、氮的氢化物为氨气,由于氨分子之间能形成氢键,所以氨气比同族其他元素形成的氢化物沸点高。
4、氯的电负性大于硫的,因为H2S+Cl2=2HCl+S↓
5、晶体的晶胞结构图可知, 1个晶胞中由4个硫化钠,由V= m/ρ可知,V为a的三次方,即可计算出晶胞的密度。
考点:原子结构与元素周期率的关系; 共价键的形成及共价键的主要类型;晶胞的计算
点评:本题考查原子结构与物质的性质,题目难度较大,元素的推断是解答本题的关键,注重对化学键、晶胞结构等高考常考查点的考查.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
 (2011?新余二模)化学--选修物质结构与性质
(2011?新余二模)化学--选修物质结构与性质查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元 素 | M | F | |
| 电能 (kJ?mol-1) |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 [化学-选修物质结构与性质]
[化学-选修物质结构与性质]查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 性质 |
A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com