
【题目】2019年10月9日,瑞典皇家科学院将诺贝尔化学奖授予古迪纳夫等三位科学家,表彰他们在锂离子电池方面的研究成果,钴酸锂电池是他们的研究成果之一,其工作原理为LixC6+Li1-xCoO2![]() C6+LiCoO2。下列说法正确的是
C6+LiCoO2。下列说法正确的是
A.放电时Li+从正极通过导线流向负极
B.放电时负极的电极反应式为:LixC6-xe-=C6+xLi+
C.充电时电池的负极与电源的正极相连
D.充电时阴极的电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+
科目:高中化学 来源: 题型:
【题目】化合物G是临床常用的镇静、麻醉药物,其合成路线流程图如下:
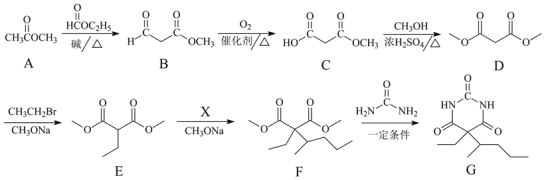
(1)B中的含氧官能团名称为______和______。
(2)D→E的反应类型为______。
(3)X的分子式为C5H11Br,写出X的结构简式:______。
(4)F→G的转化过程中,还有可能生成一种高分子副产物Y,Y的结构简式为______。
(5)写出同时满足下列条件的G的一种同分异构体的结构简式:______。
①分子中含有苯环,能与FeCl3溶液发生显色反应
②分子中只有4种不同化学环境的氢
(6)写出以CH2BrCH2CH2Br、CH3OH和CH3ONa为原料制备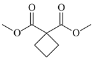 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应: PCl5(g) ![]() Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
反应时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
(1)能表明该反应达到平衡状态的是________(填序号);
A.生成1molPCl3的同时生成1molPCl5 B.混合气体的平均相对分子质量不变
C.PCl5、Cl2、PCl3三者的浓度比值1:1:1 D.混合气体的密度不变
(2)上述温度下,达到平衡时,PCl5的转化率为____;该反应的平衡常数K= ___。
(3)反应在前50 s内的平均速率为v(PCl3)=_____。
(4)保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11moI·L-l,则正反应的ΔH__0(填“>”或“<”)。
(5)相同温度下,若起始时向容器中充入1.0 molPCl5、0.20mol PCl3和0.20 mol Cl2,则反应达到平衡前v(正) __ v(逆)(填“>”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是
A.图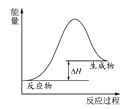 可表示石灰石分解反应的能量变化
可表示石灰石分解反应的能量变化
B.图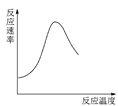 可表示酶催化反应的反应速率随反应温度的变化
可表示酶催化反应的反应速率随反应温度的变化
C.图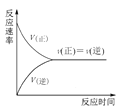 可表示在一定条件的可逆反应中,正反应速率和逆反应速率随时间的变化
可表示在一定条件的可逆反应中,正反应速率和逆反应速率随时间的变化
D.图 可表示向H2SO4溶液中滴加Ba(OH)2溶液,溶液的导电性随碱溶液体积的变化
可表示向H2SO4溶液中滴加Ba(OH)2溶液,溶液的导电性随碱溶液体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成(CH3)4NOH,其工作原理如下图所示(a、b为石墨电板,c、d、e为离子交换膜),下列说法正确的是( )
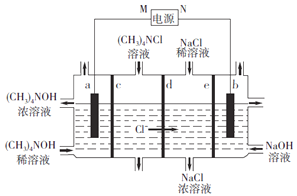
A. M为正极 B. c、e均为阳离子交换膜
C. b极电极反应式:2H2O-4e-=O2↑+4H+ D. 制备1mol(CH3)4NOH,a、b两极共产生0.5mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与对应的方程式不符合的是
A. 硫化氢溶液呈酸性:H2S ![]() 2H++S2–
2H++S2–
B. “NO2球”浸泡在冷水中,颜色变浅:2NO2(g) (红棕色) ![]() N2O4 (g) (无色) ΔH<0
N2O4 (g) (无色) ΔH<0
C. 甲烷的燃烧热ΔH=–890.3 kJ·mol–1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=–890.3 kJ·mol–1
D. 硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32–+2H+=S +SO2 +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 A、B、C、D 的原子序数依次递增,它们的核电荷数之和 32,原子最外层电子数之和为 10,A与 C同主族,B与 D同主族,A、C原子最外层电子数之和等于 B 原子的次外层电子数,则下列叙述中正确的是
A.一定条件下,B 单质能置换出 D 单质,C 单质能置换出 A 单质
B.四种元素的原子半径:r(A)<r(B)<r(C)<r(D)
C.B、D 的最高价氧化物中,B、D 与氧原子均为双键
D.D 元素处于元素周期表中第 3 周期第Ⅳ族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钠是一种基础化工原料。
(1)已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(l) ΔH=-186 kJ·mol-1,3ClO-(aq)=ClO3— (aq)+2Cl-(aq) ΔH=-113 kJ·mol-1,则:3Cl2(g)+6OH-(aq)=ClO3—(aq)+5Cl-(aq)+3H2O(l)ΔH=____kJ·mol-1,该反应中生成1molClO3—,转移电子数为____。
(2)工业上采用无隔膜电解饱和食盐水可制备氯酸钠。该工艺过程中,生成氯酸钠的相关反应为:Cl2+H2O![]() H++Cl-+HClO,HClO
H++Cl-+HClO,HClO![]() H++ClO-,2HClO+ClO-=ClO
H++ClO-,2HClO+ClO-=ClO![]() +2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图。
+2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图。
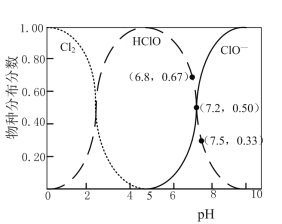
①电解过程中,为按化学计量数比反应,需控制电解液的pH约为___(填序号)。
A.5 B.6.8 C.7.2D.7.5
②若电解液碱度过大,阳极会有较多的O2放出,电极反应方程式为____。已知:Cr2O72—+H2O![]() 2CrO42—+2H+,电解时向食盐水中加入的重铬酸钠(Na2Cr2O7)可以防止电解液碱度过大,其原理是____。
2CrO42—+2H+,电解时向食盐水中加入的重铬酸钠(Na2Cr2O7)可以防止电解液碱度过大,其原理是____。
③若电解液pH<5时,溶液中HClO浓度会随pH减小迅速降低,其原因是____(用离子方程式表示)。
(3)电解时须对电解槽进行冷却处理以防止电解液温度过高的原因是____。
(4)氯酸钠与硫酸酸化的双氧水溶液反应常用于制备饮用水消毒剂ClO2(g),该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A(C9H18O2)在稀硫酸溶液中水解为相对分子质量相等的B、C,其中B分子中含有 3个甲基,则A、B、C中能与氢氧化钠溶液反应的物质最多有(不考虑立体异构)
A. 10种 B. 8种 C. 6种 D. 4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com