
【题目】一定温度时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应: PCl5(g) ![]() Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
反应时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
(1)能表明该反应达到平衡状态的是________(填序号);
A.生成1molPCl3的同时生成1molPCl5 B.混合气体的平均相对分子质量不变
C.PCl5、Cl2、PCl3三者的浓度比值1:1:1 D.混合气体的密度不变
(2)上述温度下,达到平衡时,PCl5的转化率为____;该反应的平衡常数K= ___。
(3)反应在前50 s内的平均速率为v(PCl3)=_____。
(4)保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11moI·L-l,则正反应的ΔH__0(填“>”或“<”)。
(5)相同温度下,若起始时向容器中充入1.0 molPCl5、0.20mol PCl3和0.20 mol Cl2,则反应达到平衡前v(正) __ v(逆)(填“>”或“<”)
【答案】A、B 20% 0.025 mol/L 1.6×10-3 mol/(L·s) > >
【解析】
(1)根据化学平衡的特征和本质反分析判断;
(2)利用三段式,结合转化率的概念和平衡常数K=![]() 计算;
计算;
(3)根据v=![]() =
=![]() 计算v(PCl3);
计算v(PCl3);
(4)由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,新平衡时c(PCl3)=0.11 mol/L,则n′(PCl3)=0.22mol>0.2mol,结合温度对平衡的影响分析判断;
(5)首先计算浓度商Qc,再根据Qc和K的大小关系分析判断。
(1)A.生成1molPCl3的同时生成1molPCl5,表示正逆反应速率相等,说明反应达到平衡状态,故A正确;B.该反应为气体的物质的量增大的反应,混合气体的质量不变,则混合气体的平均相对分子质量为变量,当混合气体的平均相对分子质量不变,表明反应达到平衡状态,故B正确;C.PCl5、Cl2、PCl3三者的浓度比值1∶1∶1,不能说明浓度是否不变,不能说明反应达到平衡状态,故C错误;D.混合气体的质量和体积不变,混合气体的密度始终不变,不能说明反应达到平衡状态,故D错误;故答案为:AB;
(2)相同温度下,向容器中再充入1.0molPCl5,根据表格数据,平衡时n(PCl3)=0.2mol,则
PCl5(g)PCl3(g)+Cl2(g)
起始量(mol/L) 0.5 0 0
变化量(mol/L)0.1 0.1 0.1
平衡量(mol/L)0.4 0.1 0.1
平衡时PCl5转化率=![]() ×100%=20%,平衡常数K=
×100%=20%,平衡常数K=![]() =0.025,故答案为:20%;0.025;
=0.025,故答案为:20%;0.025;
(3)由表中数据可知50s内,△n(PCl3)=0.16mol,v(PCl3)=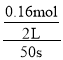 =0.0016mol/(Ls),故答案为:0.0016mol/(Ls);
=0.0016mol/(Ls),故答案为:0.0016mol/(Ls);
(4)由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,新平衡时c(PCl3)=0.11 mol/L,则n′(PCl3)=0.11 mol/L×2L=0.22mol>0.2mol,说明升高温度,平衡正向移动,正反应为吸热反应,即△H>0,故答案为:>;
(5)相同温度下,平衡常数K相同。起始时向容器中充入1.0 mol PCl5、0.20 molPCl3和0.20 molCl2,起始时PCl5的浓度为0.5mol/L、PCl3的浓度为0.1mol/L、Cl2的浓度为0.1mol/L,浓度商Qc=![]() =0.02<K=0.025,说明反应向正反应方向进行,反应达平衡前v(正)>v(逆),故答案为:>。
=0.02<K=0.025,说明反应向正反应方向进行,反应达平衡前v(正)>v(逆),故答案为:>。


科目:高中化学 来源: 题型:
【题目】将H2和CO以![]() =2的方式充入1 L的恒容密闭容器中,一定条件下发生反应:4H2(g)+2CO(g)
=2的方式充入1 L的恒容密闭容器中,一定条件下发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),测得CO的平衡转化率随温度、压强变化关系如图所示。下列说法正确的是
CH3OCH3(g)+H2O(g),测得CO的平衡转化率随温度、压强变化关系如图所示。下列说法正确的是
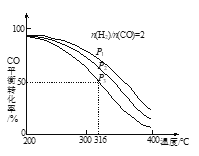
A.该反应的△H<0
B.压强大小:P1<P2<P3
C.在316℃时,该反应的平衡常数为0.25
D.若在P3和316℃时,起始时![]() =3,则达到平衡时,CO转化率大于50%
=3,则达到平衡时,CO转化率大于50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学来源于生活又服务于生活,请用化学用语回答下列问题:
(1)漂粉精中有效成分的化学式为:___________
(2)“硅材料”是无机非金属材料的主角,其中广泛应用于光导纤维的材料是:____________
(3)向浑浊的水中加入明矾KAl(SO4)2·12H2O后,水可得到净化。写出明矾在水中的电离方程式:___________。往明矾溶液中逐滴加入Ba(OH)2溶液,若使SO42- 恰好完全沉淀,发生反应的离子方程式为:___________;若使Al3+恰好完全沉淀,发生反应的离子方程式为:_____。
(4)饮用水中的NO3-对人类健康产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为: 10Al + 6NaNO3 + 4NaOH = 10NaAlO2 + 3N2↑ + 2H2O
请回答下列问题:
①在化学方程式上用单线桥标出该反应中电子转移的方向和数目:____________
②上述反应中若生成标准状况下3.36LN2,则转移的电子数目为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含镍酸性废水中用电解法可以实现铁上镀镍并得到氯化钠,其装置如图所示,下列叙述正确的是

A.待镀铁棒为阳极
B.选用镍棒替换碳棒,镀镍效果更好
C.阳极的电极反应式为4OH- — 4e-=O2↑+2H2O
D.通电后中间隔室的NaCl溶液浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—空气电池是一种新型的二次电池,其放电时工作原理如图所示,下列说法正确的是()
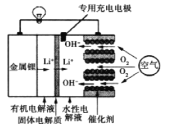
A.该电池放电时,正极的反应式为O2+4e-+4H+=2H2O
B.该电池充电时,阴极发生了氧化反应:Li++e-=Li
C.放电时电子由空气极经导线向金属锂电极移动
D.充电时,空气极与直流电源正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(已知H2C2O4是弱酸)
实验 序号 | 实验 温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | c(mol/L) | V(mL) | c(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.05 | 8 | 0.25 | 0 | t1 |
B | T1 | 2 | 0.05 | 6 | 0.25 | V1 | 8 |
C | 313K | 2 | 0.05 | 6 | 0.25 | 2 | t2 |
(1)通过实验A、B,可探究出___的改变对反应速率的影响,其中
(2)通过实验____可探究出温度变化对化学反应速率的影响。
(3)若t1<8,则由实验A、B可以得出的结论是____;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为______。
(4)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式 ________。
(5)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是 ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用花生油中含有油酸,油酸是一种不饱和脂肪酸,对人体健康有益.其分子结构如图所示,下列说法不正确的是( )

A. 油酸的分子式为C18H34O2
B. 油酸可与氢氧化钠溶液发生中和反应
C. 1mol油酸可与2molH2发生加成反应
D. 1mol甘油可与3mol油酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日,瑞典皇家科学院将诺贝尔化学奖授予古迪纳夫等三位科学家,表彰他们在锂离子电池方面的研究成果,钴酸锂电池是他们的研究成果之一,其工作原理为LixC6+Li1-xCoO2![]() C6+LiCoO2。下列说法正确的是
C6+LiCoO2。下列说法正确的是
A.放电时Li+从正极通过导线流向负极
B.放电时负极的电极反应式为:LixC6-xe-=C6+xLi+
C.充电时电池的负极与电源的正极相连
D.充电时阴极的电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com