
【题目】在含镍酸性废水中用电解法可以实现铁上镀镍并得到氯化钠,其装置如图所示,下列叙述正确的是

A.待镀铁棒为阳极
B.选用镍棒替换碳棒,镀镍效果更好
C.阳极的电极反应式为4OH- — 4e-=O2↑+2H2O
D.通电后中间隔室的NaCl溶液浓度减小
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙烯的球棍模型为![]()
B.CH2=CH—CH3分子中,最多有7个原子共面
C.用溴水或酸性KMnO4溶液可以区分甲烷和乙烯,也可以除去甲烷中的乙烯杂质得到纯净甲烷
D.C2H4和SO2都能使溴水褪色,又能使酸性KMnO4溶液褪色,并且化学反应原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是临床常用的镇静、麻醉药物,其合成路线流程图如下:
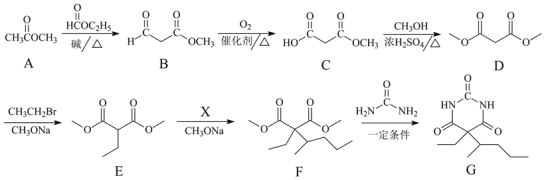
(1)B中的含氧官能团名称为______和______。
(2)D→E的反应类型为______。
(3)X的分子式为C5H11Br,写出X的结构简式:______。
(4)F→G的转化过程中,还有可能生成一种高分子副产物Y,Y的结构简式为______。
(5)写出同时满足下列条件的G的一种同分异构体的结构简式:______。
①分子中含有苯环,能与FeCl3溶液发生显色反应
②分子中只有4种不同化学环境的氢
(6)写出以CH2BrCH2CH2Br、CH3OH和CH3ONa为原料制备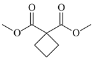 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论都正确的是 ( )
选项 | 实验操作 | 现象 | 结论 |
A | 将石蜡油分解产生的气体通入酸性高锰酸钾溶液中 | 紫红色溶液变无色 | 石蜡油裂解一定产生了乙烯 |
B | 用水浸过的棉花包裹铁粉放入试管并加热,将气体通入四氯化碳溶液中 | 四氯化碳中产生气泡 | 铁粉与水蒸气在高温下一定产生了氢气 |
C | 向重铬酸钾溶液中滴加乙醇 | 橙红色溶液变绿色 | 乙醇表现出还原性 |
D | 向2ml0.1mol/L的AgNO3溶液中先滴加2滴0.1mol/L NaCl溶液,再滴入 | 先产生白色沉淀,后沉淀变成黄色 | 相同温度下,AgCl在水中的溶解度大于AgI的溶解度 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①0.2mol/LNaOH溶液和②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X—)。则:
(1)①中由水电离出的c(OH)-___②中由水电离出的c(H+)。(填“>”、“=”或“<”)
(2)上述混合液中共存在___种粒子。且:c(HX)___c(X-)。(填“>”、“=”或“<”,下同)c(HX)+c(X-)___0.1mol/L(忽略体积变化)
请根据电荷守恒写出一个用离子浓度表示的等式:___。
(3)上述混合液显___性(填“酸”、“碱”或“中”),其原因用离子方程式表示___。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)___25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应: PCl5(g) ![]() Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
反应时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
(1)能表明该反应达到平衡状态的是________(填序号);
A.生成1molPCl3的同时生成1molPCl5 B.混合气体的平均相对分子质量不变
C.PCl5、Cl2、PCl3三者的浓度比值1:1:1 D.混合气体的密度不变
(2)上述温度下,达到平衡时,PCl5的转化率为____;该反应的平衡常数K= ___。
(3)反应在前50 s内的平均速率为v(PCl3)=_____。
(4)保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11moI·L-l,则正反应的ΔH__0(填“>”或“<”)。
(5)相同温度下,若起始时向容器中充入1.0 molPCl5、0.20mol PCl3和0.20 mol Cl2,则反应达到平衡前v(正) __ v(逆)(填“>”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是
A.图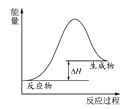 可表示石灰石分解反应的能量变化
可表示石灰石分解反应的能量变化
B.图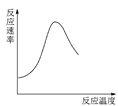 可表示酶催化反应的反应速率随反应温度的变化
可表示酶催化反应的反应速率随反应温度的变化
C.图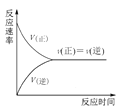 可表示在一定条件的可逆反应中,正反应速率和逆反应速率随时间的变化
可表示在一定条件的可逆反应中,正反应速率和逆反应速率随时间的变化
D.图 可表示向H2SO4溶液中滴加Ba(OH)2溶液,溶液的导电性随碱溶液体积的变化
可表示向H2SO4溶液中滴加Ba(OH)2溶液,溶液的导电性随碱溶液体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钠是一种基础化工原料。
(1)已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(l) ΔH=-186 kJ·mol-1,3ClO-(aq)=ClO3— (aq)+2Cl-(aq) ΔH=-113 kJ·mol-1,则:3Cl2(g)+6OH-(aq)=ClO3—(aq)+5Cl-(aq)+3H2O(l)ΔH=____kJ·mol-1,该反应中生成1molClO3—,转移电子数为____。
(2)工业上采用无隔膜电解饱和食盐水可制备氯酸钠。该工艺过程中,生成氯酸钠的相关反应为:Cl2+H2O![]() H++Cl-+HClO,HClO
H++Cl-+HClO,HClO![]() H++ClO-,2HClO+ClO-=ClO
H++ClO-,2HClO+ClO-=ClO![]() +2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图。
+2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图。
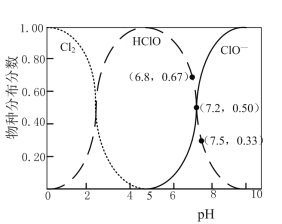
①电解过程中,为按化学计量数比反应,需控制电解液的pH约为___(填序号)。
A.5 B.6.8 C.7.2D.7.5
②若电解液碱度过大,阳极会有较多的O2放出,电极反应方程式为____。已知:Cr2O72—+H2O![]() 2CrO42—+2H+,电解时向食盐水中加入的重铬酸钠(Na2Cr2O7)可以防止电解液碱度过大,其原理是____。
2CrO42—+2H+,电解时向食盐水中加入的重铬酸钠(Na2Cr2O7)可以防止电解液碱度过大,其原理是____。
③若电解液pH<5时,溶液中HClO浓度会随pH减小迅速降低,其原因是____(用离子方程式表示)。
(3)电解时须对电解槽进行冷却处理以防止电解液温度过高的原因是____。
(4)氯酸钠与硫酸酸化的双氧水溶液反应常用于制备饮用水消毒剂ClO2(g),该反应的化学方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com