
【题目】现有①0.2mol/LNaOH溶液和②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X—)。则:
(1)①中由水电离出的c(OH)-___②中由水电离出的c(H+)。(填“>”、“=”或“<”)
(2)上述混合液中共存在___种粒子。且:c(HX)___c(X-)。(填“>”、“=”或“<”,下同)c(HX)+c(X-)___0.1mol/L(忽略体积变化)
请根据电荷守恒写出一个用离子浓度表示的等式:___。
(3)上述混合液显___性(填“酸”、“碱”或“中”),其原因用离子方程式表示___。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)___25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=___。
【答案】< 6 < = c(Na+)+c(H+)=c(X-)+c(OH-) 碱 X-+H2O![]() HX+OH- > 9:2
HX+OH- > 9:2
【解析】
首先如果HX为强酸则会完全电离,和钠离子的浓度相同,然而不同,说明HX为弱酸,(1)、(2)、(3)靠电荷守恒,物料守恒可以解答。
(4)、水的电离是吸热反应,升高温度促进水电离,其离子积常数增大;该温度下pH=11的NaOH浓度为0.01mol/L、pH=1的硫酸溶液中氢离子浓度为0.1mol/L,二者混合后pH=2,则混合溶液中氢离子浓度为0.01mol/L,据此解答。
(1)、氢氧化钠为强碱电离的氢氧根多,抑制水电离氢氧根程度大,HX为弱酸,电离的氢离子较少,对水电离氢离子的抑制小,①中由水电离出的c(OH-)②中由水电离出的c(H+),故答案为:>;
(2)、溶液中有H2O、OH-、H+、HX、X-、Na+六种离子,不论是弱酸的电离还是水解,程度都是比较小的,所以:c(HX)<c(X-),根据物料守恒:c(HX)+c(X-)应该是等于0.1mol/L的,电荷守恒有c(Na+)+c(H+)=c(X-)+c(OH-),故答案为:6 ;< ;= ;c(Na+)+c(H+)=c(X-)+c(OH-);
(3)、溶液相当于NaX的液体,HX为弱酸,则有X-+H2O![]() HX+OH-,溶液显碱性,故答案为:碱;X-+H2O
HX+OH-,溶液显碱性,故答案为:碱;X-+H2O![]() HX+OH-;
HX+OH-;
(4)、水的电离是吸热反应,升高温度促进水电离,其离子积常数增大,Kw= 1×10-13> 1×10-14,则t℃> 25℃,该温度下pH=11的NaOH浓度为0.01mol/L、pH=1 的硫酸溶液中氢离子浓度为0.1mol/L,二者混合后pH=2,则混合溶液中氢离子浓度为0.01mol/L=![]() ,a: b=9:2,故答案为:> ;9:2.。
,a: b=9:2,故答案为:> ;9:2.。


科目:高中化学 来源: 题型:
【题目】(1)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为________________________,若将负极材料改为CH4,写出其负极反应方程式_________________________。
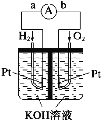
(2)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2molL﹣1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为____________________;每消耗3.4g NH3转移的电子数目为_________。
(3)图为青铜器在潮湿环境中因发生电化学反应而被腐蚀的原理示意图。

①腐蚀过程中,负极是_______(填图中字母“a”或“b”或“c”);
②环境中的Cl- 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为______________;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为_______L(标况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中,A、C及B、D分别是同主族元素;A元素的原子半径是所有主族元素中原子半径最小的;B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中A、B单质是气体,C、D单质是固体。
(1)写出以下元素的名称:B___;C___。
(2)写出D元素在周期表中的位置___。
(3)用电子式表示C2D的形成过程:___。
(4)写出由B、C两元素所形成的原子个数比为1:1的化合物的的电子式___;属于___(填“离子”或“共价”)化合物,存在的化学键的种类有___;写出它与水反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象推出的相应结论正确的是 ( )
选项 | 实验 | 现象 | 结论 |
A | 某溶液中滴加K3 [Fe(CN)6]溶液 | 产生蓝色沉淀 | 原溶液中有Fe2+,Fe3+ |
B | 向C6H5ONa溶液中通入CO2 | 溶液变浑浊 | 酸性:H2CO3>C6H5OH |
C | 向K2Cr2O7的酸性溶液中滴加乙醇 | 橙色溶液变为绿色 | 乙醇发生消去反应生成乙烯 |
D |
|
| 原溶液中有SO42- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含镍酸性废水中用电解法可以实现铁上镀镍并得到氯化钠,其装置如图所示,下列叙述正确的是

A.待镀铁棒为阳极
B.选用镍棒替换碳棒,镀镍效果更好
C.阳极的电极反应式为4OH- — 4e-=O2↑+2H2O
D.通电后中间隔室的NaCl溶液浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
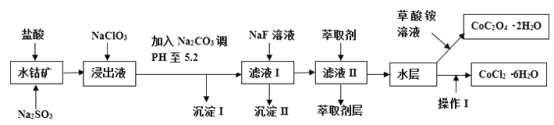
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;②沉淀I中只含有两种沉淀;③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为_________________。
(2)NaClO3在浸出液中发生的离子反应方程式为______________。
(3)加入Na2CO3调PH至5.2,目的是________;萃取剂层含锰元素,则沉淀II的主要成分为_____。
(4)操作I包括:将水层加入浓盐酸调整PH为2-3,______、_____、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是_____(回答一条原因即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(已知H2C2O4是弱酸)
实验 序号 | 实验 温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | c(mol/L) | V(mL) | c(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.05 | 8 | 0.25 | 0 | t1 |
B | T1 | 2 | 0.05 | 6 | 0.25 | V1 | 8 |
C | 313K | 2 | 0.05 | 6 | 0.25 | 2 | t2 |
(1)通过实验A、B,可探究出___的改变对反应速率的影响,其中
(2)通过实验____可探究出温度变化对化学反应速率的影响。
(3)若t1<8,则由实验A、B可以得出的结论是____;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为______。
(4)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式 ________。
(5)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是 ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列八种有机物:
现有下列八种有机物:①CH4,②CH3CH2OH,③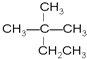 ,④癸烷,⑤CH3COOH,⑥
,④癸烷,⑤CH3COOH,⑥![]() ,⑦
,⑦![]() ,⑧丙烷
,⑧丙烷
根据上述物质,回答下列问题:
(1)相对分子质量为44的烷烃的结构简式为___________________。
(2)与③互为同分异构体的是__________![]() 填序号
填序号![]() 。
。
(3)具有特殊气味,常作萃取剂的某有机物在FeBr3作催化剂的条件下可与液溴发生取代反应,该反应的化学方程式为________________。
(4)有机物②在加热条件下和CuO反应的化学方程式为______________________。
(5)在120℃,1.01×105Pa条件下,某种气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃是__________![]() 填序号
填序号![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理部分含硫废水。某小组在实验室中利用下列装置制备ClO2(此制备方法中经空气稀释的SO2与ClO2不反应)。
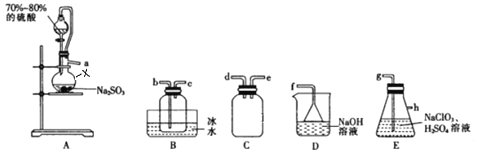
回答下列问题:
(1)仪器X的名称是__________________________。
(2)欲选择上图中的装置收集ClO2,其连接顺序为a→______(按气流方向,用小写字母表示)。
(3)装置C的作用是_________,装置E中反应的离子方程式为__________________________________。
(4)处理含硫(Na2S)碱性废水时,ClO2与Na2S反应(S2-被氧化为SO42-)的离子方程式为_________________;处理含硫碱性废水时,相同条件下同体积的ClO2相对于Cl2的优点是______________________________。
(5)ClO2很不稳定,需现用现配,为测定所得溶液中ClO2的含量,进行下列实验:
步骤1:准确量取V1 mL ClO2溶液加入锥形瓶中。
步骤2:用稀硫酸调节ClO2溶液的pH≤2.0,再加入足量KI晶体,静置片刻。
步骤3:加入指示剂,用c mol·L-1的Na2S2O3标准溶液滴定至终点时,消耗V2 mL Na2S2O3标准溶液。
(已知:2ClO2+8H++10I-===2C1-+5I2+4H2O;2S2O32-+I2===2I-+S4O62-)原溶液中ClO2的含量为____________(用含c、V1、V2的代数式表示)g·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com