
【题目】某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(已知H2C2O4是弱酸)
实验 序号 | 实验 温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | c(mol/L) | V(mL) | c(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.05 | 8 | 0.25 | 0 | t1 |
B | T1 | 2 | 0.05 | 6 | 0.25 | V1 | 8 |
C | 313K | 2 | 0.05 | 6 | 0.25 | 2 | t2 |
(1)通过实验A、B,可探究出___的改变对反应速率的影响,其中
(2)通过实验____可探究出温度变化对化学反应速率的影响。
(3)若t1<8,则由实验A、B可以得出的结论是____;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为______。
(4)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式 ________。
(5)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是 ____。
【答案】浓度 2 293K < BC 其他条件相同时,增大反应物浓度,反应速率增大 1.25×10-3mol/(L·s) 2MnO42-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 作催化剂
【解析】
A、B滴加的H2C2O4溶液的体积不等,应控制温度相同,探究浓度对反应速率的影响,需要可知溶液的总体积相同,B、C的温度不同,结合温度对反应速率的影响和反应速率的计算公式分析解答(1)~(3);
(4)根据题意,草酸和酸性高锰酸钾溶液发生氧化还原反应生成二氧化碳、锰离子和水,据此书写反应的离子方程式;
(5)根据影响化学反应速率的因素分析判断。
(1)实验A、B,滴加H2C2O4溶液的体积不等,故实验A、B,可探究H2C2O4溶液浓度的改变对反应速率的影响;据实验A可知,需要保证溶液的总体积为10mL,B中H2C2O4溶液6mL,故需加水10mL-2mL-6mL=2mL;研究浓度对化学反应速率的影响,A、B的温度需要相同,故T1=293K;B、C溶液的浓度相同,温度不同,温度越高,反应速率越快,溶液褪色的时间越少,因此t2 <8,故答案为:浓度;2;293K;<;
(2)B、C溶液的浓度相同,温度不同,通过B、C实验可探究出温度变化对化学反应速率的影响,故答案为:BC;
(3)若t1<8,则由此实验可以得出的结论是:其他条件相同时,增大反应物浓度,反应速率增大;草酸的物质的量为0.25molL-1×0.006L=0.0015mol,高锰酸钾的物质的量为0.05molL-1×0.002L=0.0001mol,草酸和高锰酸钾的物质的量之比为0.0015mol:0.0001mol=15:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为![]() =0.01mol/L,用KMnO4的浓度变化表示的反应速率为
=0.01mol/L,用KMnO4的浓度变化表示的反应速率为![]() =0.00125mol/(L·s),故答案为:其他条件相同时,增大反应物浓度,反应速率增大;0.00125mol/(L·s);
=0.00125mol/(L·s),故答案为:其他条件相同时,增大反应物浓度,反应速率增大;0.00125mol/(L·s);
(4)草酸和酸性高锰酸钾溶液发生氧化还原反应生成二氧化碳、锰离子和水,反应的离子方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(5)反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是催化作用,相应的粒子最有可能是Mn2+,故答案为:作催化剂。


科目:高中化学 来源: 题型:
【题目】某有机化合物的结构简式如图所示,下列说法不正确的是( )
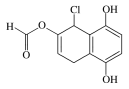
A.能发生银镜发应
B.能与FeCl3溶液发生显色反应
C.1 mol该物质最多可与4 mol NaOH反应
D.与NaHCO3、Na2CO3溶液均能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论都正确的是 ( )
选项 | 实验操作 | 现象 | 结论 |
A | 将石蜡油分解产生的气体通入酸性高锰酸钾溶液中 | 紫红色溶液变无色 | 石蜡油裂解一定产生了乙烯 |
B | 用水浸过的棉花包裹铁粉放入试管并加热,将气体通入四氯化碳溶液中 | 四氯化碳中产生气泡 | 铁粉与水蒸气在高温下一定产生了氢气 |
C | 向重铬酸钾溶液中滴加乙醇 | 橙红色溶液变绿色 | 乙醇表现出还原性 |
D | 向2ml0.1mol/L的AgNO3溶液中先滴加2滴0.1mol/L NaCl溶液,再滴入 | 先产生白色沉淀,后沉淀变成黄色 | 相同温度下,AgCl在水中的溶解度大于AgI的溶解度 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①0.2mol/LNaOH溶液和②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X—)。则:
(1)①中由水电离出的c(OH)-___②中由水电离出的c(H+)。(填“>”、“=”或“<”)
(2)上述混合液中共存在___种粒子。且:c(HX)___c(X-)。(填“>”、“=”或“<”,下同)c(HX)+c(X-)___0.1mol/L(忽略体积变化)
请根据电荷守恒写出一个用离子浓度表示的等式:___。
(3)上述混合液显___性(填“酸”、“碱”或“中”),其原因用离子方程式表示___。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)___25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应: PCl5(g) ![]() Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+PCl3(g)经一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
反应时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
(1)能表明该反应达到平衡状态的是________(填序号);
A.生成1molPCl3的同时生成1molPCl5 B.混合气体的平均相对分子质量不变
C.PCl5、Cl2、PCl3三者的浓度比值1:1:1 D.混合气体的密度不变
(2)上述温度下,达到平衡时,PCl5的转化率为____;该反应的平衡常数K= ___。
(3)反应在前50 s内的平均速率为v(PCl3)=_____。
(4)保持其他条件不变,若升高温度,反应重新达到平衡,平衡时c(PCl3)=0.11moI·L-l,则正反应的ΔH__0(填“>”或“<”)。
(5)相同温度下,若起始时向容器中充入1.0 molPCl5、0.20mol PCl3和0.20 mol Cl2,则反应达到平衡前v(正) __ v(逆)(填“>”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述中,不正确的是( )
A. 淀粉![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B. 纤维素![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C. 油脂![]() 甘油和高级脂肪酸
甘油和高级脂肪酸![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D. 蛋白质![]() 氨基酸
氨基酸![]() 人体所需的蛋白质(人体生长发育)
人体所需的蛋白质(人体生长发育)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是
A.图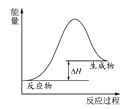 可表示石灰石分解反应的能量变化
可表示石灰石分解反应的能量变化
B.图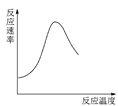 可表示酶催化反应的反应速率随反应温度的变化
可表示酶催化反应的反应速率随反应温度的变化
C.图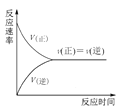 可表示在一定条件的可逆反应中,正反应速率和逆反应速率随时间的变化
可表示在一定条件的可逆反应中,正反应速率和逆反应速率随时间的变化
D.图 可表示向H2SO4溶液中滴加Ba(OH)2溶液,溶液的导电性随碱溶液体积的变化
可表示向H2SO4溶液中滴加Ba(OH)2溶液,溶液的导电性随碱溶液体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与对应的方程式不符合的是
A. 硫化氢溶液呈酸性:H2S ![]() 2H++S2–
2H++S2–
B. “NO2球”浸泡在冷水中,颜色变浅:2NO2(g) (红棕色) ![]() N2O4 (g) (无色) ΔH<0
N2O4 (g) (无色) ΔH<0
C. 甲烷的燃烧热ΔH=–890.3 kJ·mol–1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=–890.3 kJ·mol–1
D. 硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32–+2H+=S +SO2 +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列5种有机物:
① HCOOCH3 ② CH3COOH ③ CH3—CH=CH2 ④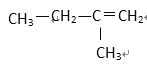 ⑤
⑤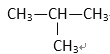
(1) 其中符合通式CnH2n+2的是________ ( 填序号,下同 ), 与 ①互为同分异构体的是_________,与 ③ 互为同系物的是___________
(2) 用系统命名法给 ⑤ 命名,其名称为 _________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com