
【题目】锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( ) 
A.放电时左侧电解质储罐中的离子总浓度增大
B.充电时电极a连接电源的负极
C.放电时负极的电极反应式为Zn﹣2e﹣═Zn2+
D.阳离子交换膜可阻止Br2与Zn直接发生反应
【答案】B
【解析】解:A.放电时,左侧为正极,电极反应式为Br2+2e﹣=2Br﹣ , 且氧离子从右侧通入阳离子交换膜进入左侧,所以左侧电解质储罐中的离子总浓度增大,故A正确; B.充电时,a极为阳极,应该连接电源正极,故B错误;
C.放电时,负极上Zn失电子发生氧化反应,电极反应式为Zn﹣2e﹣═Zn2+ , 故C正确;
D.阳离子交换膜只能阳离子通过,分子或阴离子不能通过,所以阳离子交换膜可阻止Br2与Zn直接发生反应,故D正确;
故选B.
放电时,该装置是原电池,Zn易失电子作负极,电极反应式为Zn﹣2e﹣═Zn2+ , 正极反应式为Br2+2e﹣=2Br﹣ , 充电时,阳极、阴极与正极、负极电极反应式正好相反,阳离子交换膜只能阳离子通过,分子或阴离子不能通过,据此分析解答.


科目:高中化学 来源: 题型:
【题目】下列离子方程式,正确的是( )
A.氢氧化钠溶液中加入少量碳酸氢钙溶液:Ca2++HCO ![]() +OH﹣═CaCO3↓+H2O
+OH﹣═CaCO3↓+H2O
B.氯气和水反应:Cl2+H2O═2H++Cl﹣+Cl﹣+ClO﹣
C.二氧化硅与烧碱溶液反应:SiO2+2OH﹣═SiO ![]() +H2O
+H2O
D.氯化铝溶液中加入过量氨水:Al3++4NH3?H2O═AlO ![]() +4NH
+4NH ![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把13g含有SiO2的CaCO3固体在高温下加热到质量不再改变,冷却后称量为8.6g则生成的CO2在标准状况下的体积为L,原混合物中含SiO2的质量g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的科学,正确的实验操作是完成实验任务的保证。下列做法中,不合理的是( )
A. 在实验室里制取气体时,先检查装置的气密性
B. 做铁丝在氧气中燃烧实验时,预先在集气瓶中加少量水
C. 稀释浓硫酸时,将浓硫酸注入盛水的量筒中
D. 做氢气燃烧实验时,先检查氢气的纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知:N≡N键的键能是948.9kJmol﹣1 , H﹣H键的键能是436.0kJmol﹣1;由N2和H2合成1mol NH3时可放出46.2kJ的热量.N﹣H键的键能是
(2)由氢气和氧气反应生成1mol水蒸气,放热241.8KJ.写出该反应的热化学方程式:① .
已知常温下NO与O2反应生成1molNO2的焓变为﹣57.07KJ,1molNO2与H2O反应生成HNO3溶液和NO的焓变为﹣46KJ,写出NO与O2及水生成HNO3溶液的热化学方程式② .
(3)某温度下纯水中的c(H+)=2×10﹣7mol/L,则此时c(OH﹣)=mol/L,该纯水的pH(填“>7”、“<7”、“=7”).若温度不变,滴入稀硫酸使c(H+)=5×10﹣6mol/L,则c(OH﹣)=mol/.
(4)纳米MgO可用于尿素与氯化镁合成.某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响.请完成以下实验设计表:
编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
① | 378 | 3 | 3:1 | 实验②和④探究 |
② | 378 | 4 | 4:1 | |
③ | 378 | 3 | ||
④ | 398 | 4 | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某Na2CO3溶液中逐滴滴加1 mol·L-1的盐酸,测得溶液中Cl-、HCO的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法中正确的是( )

A.Oa段反应的离子方程式与ab段反应的离子方程式相同
B.该Na2CO3溶液中含有1 mol Na2CO3
C.b点的数值为0.6
D.b点时生成CO2的物质的量为0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素形成的纯净物A、B、C、D、E,五种物质之间的转化关系如图1所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的一种相同).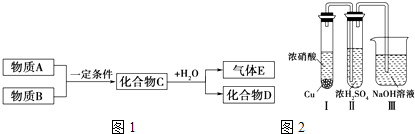
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,则C的化学式 , 并任写一种C的主要用途 .
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物.
①用电离方程式解释D既能溶于强酸、又能溶于强碱的原因(仅写出电离方程式即可): .
②用电荷守恒的等式表示E与NaOH溶液反应生成正盐的溶液中所有离子的浓度之间的关系: .
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 .
②已知常温下物质A与物质B反应生成1mol气体C的△H=﹣57kJmol﹣1 , 1mol气体C与H2O反应生成化合物D和气体E的△H=﹣46kJmol﹣1 , 写出物质A与物质B及水反应生成化合物D的热化学方程式为 .
③有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用如图2所示装置进行实验.
实验过程中,在浓H2SO4中未发现有气体逸出,则得出的结论是 .
④用铂做电极电解H2SO4的溶液,其阳极的电极反应式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com