
【题目】氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O![]() HClO + H++Cl-K2=10-3.4
HClO + H++Cl-K2=10-3.4
HClO![]() H++ ClO-Ka=?
H++ ClO-Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )

A. Cl2(g)+ H2O![]() 2H++ ClO-+ Cl-K=10-10.9
2H++ ClO-+ Cl-K=10-10.9
B. 在氯处理水体系中,c(HClO) + c(ClO-) =c(H+)-c(OH-)
C. 用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时好
D. 氯处理饮用水时,在夏季的杀菌效果比在冬季差
【答案】D
【解析】
试题根据图象知,HClO![]() H++ClO-中pH=7.5,Ka= c(H+)c(ClO-)/c(HClO)=10-7.5;A、将已知的三个式子相加可得Cl2(g)+ H2O
H++ClO-中pH=7.5,Ka= c(H+)c(ClO-)/c(HClO)=10-7.5;A、将已知的三个式子相加可得Cl2(g)+ H2O![]() 2H++ ClO-+ Cl-,所以K=K1·K2·Ka=10-1.2×10-3.4×10-7.5=10-12.1,错误;B、体系中存在电荷守恒c(H+)=c(Cl-)+c(ClO-)+c(OH-),即c(Cl-)+c(ClO-)=c(H+)-c(OH-),在氯水中HCl完全电离、HClO部分电离,所以c(HClO)<c(Cl-),所以c(HClO)+c(ClO-)<c(H+)-c(OH-),错误;C、起杀菌作用的是HClO,由图象可知,pH=6.5时c(HClO)比pH=7.5时要大,HClO浓度越大,杀菌效果好,所以pH=7.5时杀菌效果比pH=6.5时差,错误;D、夏季相比冬季温度高,HClO易分解,所以杀菌效果不如冬季,正确。
2H++ ClO-+ Cl-,所以K=K1·K2·Ka=10-1.2×10-3.4×10-7.5=10-12.1,错误;B、体系中存在电荷守恒c(H+)=c(Cl-)+c(ClO-)+c(OH-),即c(Cl-)+c(ClO-)=c(H+)-c(OH-),在氯水中HCl完全电离、HClO部分电离,所以c(HClO)<c(Cl-),所以c(HClO)+c(ClO-)<c(H+)-c(OH-),错误;C、起杀菌作用的是HClO,由图象可知,pH=6.5时c(HClO)比pH=7.5时要大,HClO浓度越大,杀菌效果好,所以pH=7.5时杀菌效果比pH=6.5时差,错误;D、夏季相比冬季温度高,HClO易分解,所以杀菌效果不如冬季,正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示
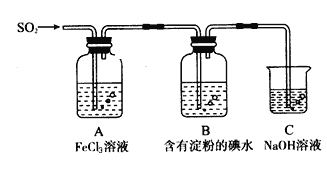
请按要求回答下列问题
(1)下列实验方案适用于在实验室制取所需SO2的是_______。
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 固体硫在纯氧中燃烧 D.铜与热浓硫酸
(2)如果有560mL SO2气体(已折算为标态)进入C装置中,则C中50mL NaOH溶液的物质的量浓度至少为____________ 才能达到目的。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、________、洗涤、自然干燥。在这一系列操作中没有用到的仪器有(填序号)____。
A.蒸发皿 B.分液漏斗 C.漏斗 D.玻璃棒 E.冷凝管
(4)在上述装置中通入过量的SO2,请设计实验验证SO2与Fe3+发生了氧化还原反应_____________________。
(5)本实验中能表明SO2的还原性比I-的还原性强的现象是__________________,其反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl-、SO42-中的几种离子。
a.取10 mL该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10 mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解,生成沉淀的物质的量随加入NaOH的物质的量关系如图所示。
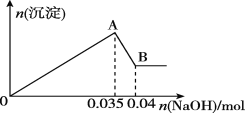
根据上述实验回答下列问题:
(1)该废水中一定不含有的离子有______________(填离子符号)
(2)实验室配制100 mL 1.0 mol·L-1的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要______________(填仪器名称)
(3)写出A→B过程中发生反应的离子方程式:______________
(4)该废水中,c(Al3+)=____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
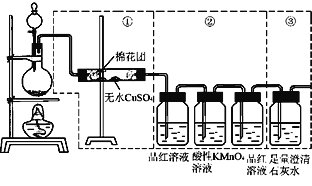
(1)浓硫酸与木炭粉在加热条件下的化学方程式为________________。
(2)如果装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检验出的物质是________________;不能检出的物质是____________。
(3)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是_____________;不能检出的物质是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学教材中元素周期表的一部分,其中标出A~Q14种元素,试回答下列问题:

(1)在上表所列出的短周期元素中
①性质最不活泼的是____________;②原子半径最大的是(除稀有气体元素)__________。
③形成的气态氢化物最稳定的是______________________________;
④最高价氧化物对应的水化物中酸性最强的是____________碱性最强的是_____________。
⑤形成的阴离子还原性最弱的是_____________,阳离子半径最小的是_____________。
(2)①B的气态氢化物与最高价氧化物对应的水化物发生反应的化学方程式为________________;
②A单质与J的最高价氧化物对应的水化物反应的方程式________________________________。
(3)设P的原子序数为Z,则F的原子序数为______________,Q的原子序数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系正确的是
A. q=2p B. q>2p C. q<2p D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
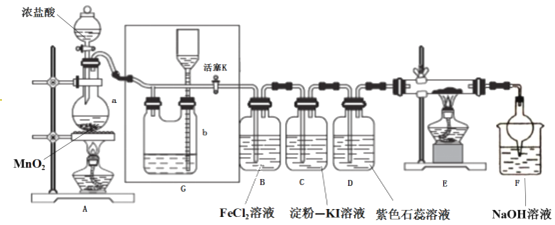
(1)A中发生反应的化学反应方程式为_________________________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置C、D中能看到的实验现象分别是 __________________ 、_______________ ;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为______________________________;
③装置F中球形干燥管的作用是____________________________;
(3)储气瓶b内盛放的试剂是______________________________;
(4)实验结束后,某同学想检验B瓶内液体是否完全与Cl2反应,可采用的方法是: __________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com