
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
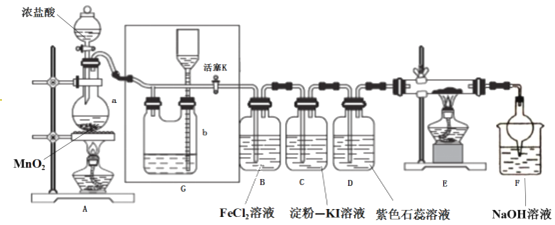
(1)A中发生反应的化学反应方程式为_________________________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置C、D中能看到的实验现象分别是 __________________ 、_______________ ;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为______________________________;
③装置F中球形干燥管的作用是____________________________;
(3)储气瓶b内盛放的试剂是______________________________;
(4)实验结束后,某同学想检验B瓶内液体是否完全与Cl2反应,可采用的方法是: __________________
【答案】MnO2+4HCl(浓)![]() MnCl2+H2O+Cl2↑溶液由无色变为蓝色溶液先变红色后褪色C+2Cl2+2H2O
MnCl2+H2O+Cl2↑溶液由无色变为蓝色溶液先变红色后褪色C+2Cl2+2H2O![]() CO2+4HCl防止倒吸饱和食盐水取少量B内液体于试管中,滴入少量铁氰酸钾溶液,若生成蓝色沉淀,则氯化亚铁未反应,若无明显现象,则氯化亚铁反应完全
CO2+4HCl防止倒吸饱和食盐水取少量B内液体于试管中,滴入少量铁氰酸钾溶液,若生成蓝色沉淀,则氯化亚铁未反应,若无明显现象,则氯化亚铁反应完全
【解析】
(1)A是制备氯气的装置,二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)![]() MnCl2+H2O+Cl2↑;故答案为:MnO2+4HCl(浓)
MnCl2+H2O+Cl2↑;故答案为:MnO2+4HCl(浓)![]() MnCl2+H2O+Cl2↑;
MnCl2+H2O+Cl2↑;
(2)①氯气有强的氧化性,能够氧化碘化钾溶液生成单质碘,碘单质遇到淀粉变蓝,所以C中现象为:溶液由无色变为蓝色;氯气与水反应生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性,所以遇到紫色石蕊试液先变红后褪色,所以D中现象为:溶液先变红色后褪色,故答案为:溶液由无色变为蓝色;溶液先变红色后褪色;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,依据得失电子守恒和原子个数守恒反应方程式:C+2Cl2+2H2O![]() CO2+4HCl,故答案为:C+2Cl2+2H2O
CO2+4HCl,故答案为:C+2Cl2+2H2O![]() CO2+4HCl;
CO2+4HCl;
③氯气、氯化氢都易溶于氢氧化钠溶液,容易发生倒吸,所以装置F中球形干燥管的作用是防倒吸;故答案为:防倒吸;
(3)氯气在饱和食盐水中溶解度不大,所以装置b中液体为饱和食盐水;故答案为:饱和食盐水;
(4)如果溶液中含有二价铁离子则加入铁氰化钾溶液会产生蓝色沉淀,所以要检测B瓶内液体是否完全与Cl2反应方法:取少量B内液体于试管中,滴入少量铁氰酸钾溶液,若生成蓝色沉淀,则氯化亚铁未反应,若无明显现象,则氯化亚铁反应完全;
故答案为:取少量B内液体于试管中,滴入少量铁氰酸钾溶液,若生成蓝色沉淀,则氯化亚铁未反应,若无明显现象,则氯化亚铁反应完全。


科目:高中化学 来源: 题型:
【题目】利用下列实验装置进行相应的实验,不能达到实验目的的是

A. 利用图甲装置,可快速制取氨气
B. 利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液
C. 利用图丙,可验证增加反应物浓度对化学平衡的影响
D. 利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性,还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体中不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:
KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)用双线桥表示该反应中电子转移的方向和数目,该反应中还原产物与氧化产物的物质的量之比是____,0.2mol KIO3参加反应时转移电子____mol。
(2)实验结束后分离I2和K2SO4溶液所用的试剂是_______。
A.CCl4 B.酒精 C.Na2SO4溶液 D.食盐水
所用的分离方法是______,所用主要玻璃仪器是_____________。
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4____mL,配制中需要用到的主要玻璃仪器是(填序号)______。
A.100mL量筒 B.托盘天平 C.玻璃棒 D.100mL容量瓶 E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是_______________
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。工业上可通过以下反应制得ClO2(提示:下面方程式中的氧元素都为负二价)2KClO3+Na2SO3+H2SO4![]() 2ClO2↑+K2SO4+Na2SO4+H2O,则下列说法中正确的是
2ClO2↑+K2SO4+Na2SO4+H2O,则下列说法中正确的是
A. KClO3在反应中是还原剂
B. 制得1mol的ClO2反应中需转移2mol电子
C. Na2SO3的还原性小于ClO2的还原性
D. 反应中被氧化的元素是S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是呼吸面具中常用的供氧剂,下列关于Na2O2的叙述正确的是( )
A. Na2O2中阴、阳离子的个数比为1:1
B. Na2O2分别与水、CO2反应,产生相同量的O2时,需要水和CO2的物质的量相等
C. Na2O2与CO2反应过程中,只做氧化剂
D. Na2O2与SO2的漂白原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
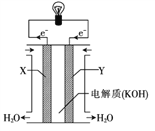
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。

(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池的负极材料是_______,负极发生的电极反应方程式为:_____________________。若反应消耗16.25 g 负极材料,则电池中转移电子的物质的量为______mol。
(2)目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
A. ①③ B. ②④ C. ①④ D. ②③
(3)右图为氢氧燃料电池的构造示意图,根据电子运动方向可知,则X极为电池的______(填“正”或“负”)极,Y极的电极反应方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1mol·L-1的HClO2和1mol·L-1的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得曲线如图所示。下列说法正确的是( )
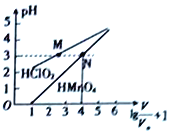
A. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
B. 在0≤pH≤5时,HMnO4溶液满足:pH=1g![]()
C. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH:NaMnO4>NaClO2
D. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
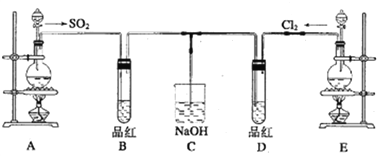
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,该同学怎样操作可以使分液漏斗液体顺利滴下___________________________;
(2)实验室用装置E制备Cl2,其反应的化学方程式为____________________,若实验室用酸性KMnO4和浓盐酸反应制Cl2,反应的离子方程式为________________________。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:_______________________,D:_________________________。
(4)若将B中品红换成Na2S溶液,通SO2一段时间后B中现象为_____________________。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,下列有关说法正确的是
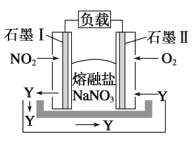
A. 石墨I极为正极,石墨II极为负极
B. Y的化学式可能为NO
C. 石墨I极的电极反应式为NO2+NO3--e-=N2O5
D. 石墨II极上发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com