
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。

(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池的负极材料是_______,负极发生的电极反应方程式为:_____________________。若反应消耗16.25 g 负极材料,则电池中转移电子的物质的量为______mol。
(2)目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
A. ①③ B. ②④ C. ①④ D. ②③
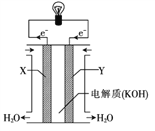
(3)右图为氢氧燃料电池的构造示意图,根据电子运动方向可知,则X极为电池的______(填“正”或“负”)极,Y极的电极反应方程式为____________________。
【答案】 锌 Zn-2e-=Zn2+ 0.5 B 负 O2+2H2O-4e-=4OH-
【解析】试题分析:(1)锌锰干电池中的负极是Zn,发生氧化反应,失去电子生成锌离子,电极反应式是 Zn-2e-=Zn2+;16.25gZn的物质的量是16.25g/65g/mol=0.25mol,每个Zn失去2个电子,所以电池中转移电子的物质的量是0.5mol;
(2)该反应的反应条件不同,所以不是可逆反应;①错误,②正确;充电时,是把电能转化为化学能,放电时是把化学能转化为电能,所以③错误,④正确,答案选B ;
(3)氢氧燃料电池中,电子从负极向正极移动,X是电子流出的一极,所以X是负极;Y是正极,发生还原反应,结合电解质溶液,氧气得到电子生成氢氧根离子,电极反应式为O2+2H2O-4e-=4OH-。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列物质均为a g,将它们在氧气中完全氧化的产物全部通入到足量的过氧化钠固体中,过氧化钠固体增重为a g,符合条件的物质种类有( )
①CO ②H2 ③CH4 ④HCHO ⑤CH3COOH ⑥HCOOH
A. 4 种 B. 5 种 C. 6种 D. 2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通常采用以下装置来制备纯净干燥的氯气,回答下列问题:
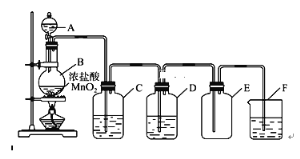
(1)写出实验室制备氯气的化学反应方程式:____________________________________。
(2)在反应中MnO2发生______(填“氧化”或“还原”,下同)反应,Cl2是______产物。
(3)装置C中所装试剂为________,其作用为_______________________________。
(4)检验氯气是否收集满的方法为:_________________________________________。
(5)F中反应的离子反应方程式为_________________________________________。
(6)工业上常用氯气与石灰水反应制备漂白粉,而久置漂白粉容易失效,请写出漂白粉失效的原理____________________________,_______________________________(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。
(1)以下操作顺序不合理的是 _______。
A.②⑤④③① B.④⑤②①③
C.⑤②④①③ D.⑤④②①③
(2)步骤①中所用的玻璃仪器有烧杯、______________、_____________。
(3)通过步骤①中过滤后的滤液,检验SO42-是否除尽的操作方法是__________
Ⅱ.碘是人体所需的必需元素,海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海洋植物中提取碘的流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
(1)上述过程灼烧海藻是在____________(填仪器名称)中进行。
(2)上述步骤②中是加入了氯水,利用氯水中的Cl2把I-氧化为I2,请写出该反应的离子方程式_____________。
(3)上述步骤③中加入了CCl4后进行振荡,振荡后静置分层,上层______色,下层_______色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
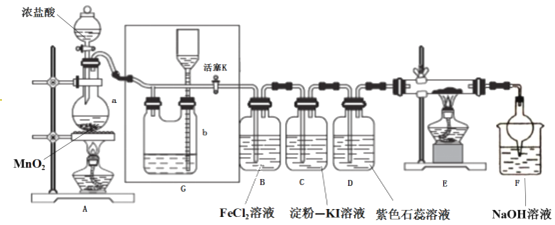
(1)A中发生反应的化学反应方程式为_________________________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置C、D中能看到的实验现象分别是 __________________ 、_______________ ;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为______________________________;
③装置F中球形干燥管的作用是____________________________;
(3)储气瓶b内盛放的试剂是______________________________;
(4)实验结束后,某同学想检验B瓶内液体是否完全与Cl2反应,可采用的方法是: __________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是一种重要的氧化物,可用于生产三氧化硫、硫酸、亚硫酸盐、硫代硫酸盐,也可用作熏蒸剂、防腐剂、消毒剂、还原剂等。
(1)SO2性质多变,若将SO2气体通入氢硫酸中,能看到的现象为:__________,该反应中SO2表现出______性;若将SO2气体通入酸性高锰酸钾溶液中,离子反应方程式为_________,该反应中SO2表现出__________性。
(2)SO2有毒,且能形成酸雨,是大气主要污染物之一。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收原理:①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2CaSO4·2H2O碱法的吸收原理:将含SO2的尾气通入足量的烧碱溶液中,请写出对应的化学反应方程式__________;
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
余石灰-石膏法相比,碱法的优点是吸收快、效率高,缺点是__________;
(3)在石灰-石膏法和碱法的基础上,设计了双碱法,能实现物料循环利用。

上述方法中,实现循环利用的物质是__________,请用化学方程式表示在Na2SO3溶液中加入CaO后的反应原理__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知草酸(H2C2O4)可使H2SO4酸化的KMnO4溶液褪色,请回答以下问题:
①在该反应中0.2mol高锰酸钾可得到1mol电子,该反应的还原产物为________(写化学式)
②请补全并配平该反应方程式:
___H2C2O4+ KMnO4+ H2SO4 → K2SO4+ + CO2↑ + H2O
(2)某溶液中可能含有以下离子:Na+、K+、Fe3+、CO32-、SO42-、Cl-,现进行如下实验:

根据实验现象回答:
该溶液中一定含有的离子是______________;一定不含有的离子是____________;无法确定的离子是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的5种短周期元素,A最外层电子数是其电子层数的两倍;B能形成双原子阴离子;C与B能形成两种常见的离子化合物,B、E同主族,C、D、E的最高价氧化物对应的水化物之间两两皆能反应生成盐和水。请回答下列问题:
(1)B的双原子阴离子电子式为_______,用化学式表示一种由B、C、E组成的物质_____。
(2)B的氢化物比E的氢化物的沸点____ (填“高”或“低”),理由是__________。
(3)B、C、D组成化合物的水溶液与过量AB2反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.根据要求回答相关问题:

(1)甲烷燃料电池的负极反应式______.
(2)石墨电极(C)的电极反应式为______.
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将______(填“增大”“减小”或“不变”).
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成标况下气体的的体积为______;丙装置中阴极析出铜的质量为______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com