
【题目】下图是中学教材中元素周期表的一部分,其中标出A~Q14种元素,试回答下列问题:

(1)在上表所列出的短周期元素中
①性质最不活泼的是____________;②原子半径最大的是(除稀有气体元素)__________。
③形成的气态氢化物最稳定的是______________________________;
④最高价氧化物对应的水化物中酸性最强的是____________碱性最强的是_____________。
⑤形成的阴离子还原性最弱的是_____________,阳离子半径最小的是_____________。
(2)①B的气态氢化物与最高价氧化物对应的水化物发生反应的化学方程式为________________;
②A单质与J的最高价氧化物对应的水化物反应的方程式________________________________。
(3)设P的原子序数为Z,则F的原子序数为______________,Q的原子序数为________________。
【答案】Ar Na HF HClO4 NaOH F- Al3+ NH3+HNO3=NH4NO3 C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O Z-44 Z+26
2SO2↑+CO2↑+2H2O Z-44 Z+26
【解析】
由元素在周期表中位置,可知A为碳、B为氮、C为氧、D为氟、E为Na、F为Mg、G为Al、H为Si、I为磷、J为S、K为Cl、L为Ar、P为Ba、Q为Pb。
(1)①稀有气体的性质最不活泼;②同周期自左而右原子半径减小,一般电子层越多原子半径越大;③非金属性越强,形成的气态氢化物越稳定;④非金属性越强,最高价氧化物对应的水化物中酸性越强,注意F没有最高正价;金属性越强,最高价氧化物对应的水化物中碱性越强;⑤非金属性越强,形成的阴离子还原性最弱越弱;电子层结构相同核电荷数越大离子半径越小,据此分析解答;
(2) ①B为氮元素,则氢化物为氨气,最高价的氧化物的水化物为硝酸,据此书写反应的化学方程式;②A为碳、J为S,据此书写碳和浓硫酸反应的化学方程式;
(3)P、F的原子序数之差为第三、第四、第五周期容纳元素种数之和;P、Q所在周期中第3列有15种元素,其它每列含有1种元素,据此分析解答。
(1)①Ar原子最外层为稳定结构,性质最不活泼,故答案为:Ar;
②同周期自左而右原子半径减小,一般电子层越多原子半径越大,故短周期中Na的原子半径最大,故答案为:Na;
③非金属性越强,氢化物越稳定,同周期自左而右非金属性增强,同主族自上而下非金属性减弱,短周期中F元素非金属性最强,气态氢化物HF最稳定,故答案为:HF;
④非金属性越强,最高价氧化物对应的水化物中酸性越强,由于F没有最高正价,因此短周期中最高价氧化物对应的水化物中酸性最强的是HClO4;金属性越强,最高价氧化物对应的水化物中碱性越强,短周期中Na的金属性最强,最高价氧化物对应的水化物中碱性最强的是NaOH,故答案为:HClO4;NaOH;
⑤F元素的非金属性最强,形成的阴离子(F-)还原性最弱;Na+、Mg2+、Al3+电子层结构相同,核电荷数越大离子半径越小,故阳离子半径最小的是:Al3+,故答案为:F-;Al3+;
(2) ①B为氮元素,则氢化物为氨气,最高价的氧化物的水化物为硝酸,二者反应生成硝酸铵,反应的化学方程式为NH3+HNO3=NH4NO3,故答案为:NH3+HNO3=NH4NO3;
②A为碳、J为S,则碳和浓硫酸反应的化学方程式为C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O,故答案为:C+2H2SO4(浓)
2SO2↑+CO2↑+2H2O,故答案为:C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;
(3)P、F的原子序数之差为第三、第四、第五周期容纳元素种数之和,设P的原子序数为Z,则F的原子序数为:Z-8-18-18=Z-44;P、Q相差14-2=12列,所在周期中第3列有15种元素,其它每列含有1种元素,故二者原子序数相差12+(15-1)=26,Q的原子序数为Z+26,故答案为:Z-44;Z+26。


科目:高中化学 来源: 题型:
【题目】将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为b g·cm-3,则该盐酸的物的量浓度是( )mol·L-1
A. 1000ab/(22400+36.5a) B. ab/(22400+36.5a)
C. 1000ab/(22.4+36.5a) D. 1000ab/(22400+36.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和压强下,把装有NO和NO2的混合气体的试管倒立于水中,充分反应后,试管内气体的体积缩小为原气体体积的![]() ,则原混合气体中NO和NO2的体积比为( )
,则原混合气体中NO和NO2的体积比为( )
A. 3∶lB. 1∶3C. 2∶3D. 3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用如图装置制取、净化、收集气体的是
选项 | 气体 | ① | ② | ③ |
|
A | NH3 | 浓氨水 | 生石灰 | 浓硫酸 | |
B | SO2 | 浓硫酸 | Na2SO3 | 浓硫酸 | |
C | NO2 | 浓硝酸 | 铜屑 | H2O | |
D | Cl2 | 浓盐酸 | MnO2 | H2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O![]() HClO + H++Cl-K2=10-3.4
HClO + H++Cl-K2=10-3.4
HClO![]() H++ ClO-Ka=?
H++ ClO-Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )

A. Cl2(g)+ H2O![]() 2H++ ClO-+ Cl-K=10-10.9
2H++ ClO-+ Cl-K=10-10.9
B. 在氯处理水体系中,c(HClO) + c(ClO-) =c(H+)-c(OH-)
C. 用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时好
D. 氯处理饮用水时,在夏季的杀菌效果比在冬季差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图虚线框中的装置可用来检验浓硫酸与木炭粉的加热条件下反应产生的所有气体产物,填写下列空白:

(1)如果装装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检出的物质是____________;不能检出的物质是____________。
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是____________;不能检出的物质是____________。
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是____________;不能检出的物质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某同学帮助水质检测站配制480mL0.5mol·L-1NaOH溶液以备使用。
(1)其操作步骤如乙图所示,则甲图操作应在乙图中的______之间。
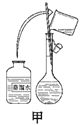
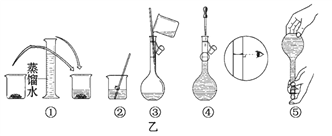
A.②与③ B.①与② C.③与④
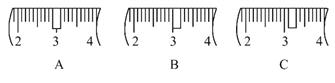
(2)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在在下图中选出能正确表示游码位置的选项________(填字母)。
Ⅱ.现有下列A、B、C三种常用化学仪器,请回答下列有关问题:
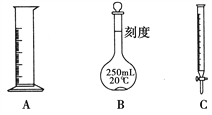
(1)三种化学仪器中标有“0”刻度的为________(填名称)。
(2)三种化学仪器在使用时首先需要检验是否漏液的为________(填字母代号)。
(3)用三种化学仪器中的一种对液体体积进行计量,正确的读数为n mL,仰视读数为x mL,俯视读数为y mL,若y>n>x,则所用量器是________(填名称)。
Ⅲ.化学课外活动小组设计了如下图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性。
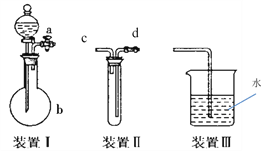
(1)实验前要检验装置Ⅰ的气密性,写出操作方法____________;
(2)利用装置Ⅱ可直接收集CO2,进气口为_____________。
(3)以上三个装置可组成实验室制取NH3,利用装置Ⅲ 吸收NH3时会发生倒吸,可向水中再加入一种液体可防止倒吸的发生,该液体为________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:

已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)盐酸溶解MnCO3的化学方程是______________,滤渣1的主要成分为________________。
(2)向溶液1中加入双氧水时,反应的离子方程式是___________________。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是__________________,在CuS和MnS共存的悬浊液中,c(Cu2+)/c(Mn2+)=_____________ (Ksp(CuS)=1.2×10-36,Ksp(MnS)=2.5×10-13)。
(4)在酸性条件下,NaClO3溶液将MnCl2氧化为MnO2,其还原产物为Cl2,该反应的离子方程式为 ___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲降低废水中重金属元素铬的毒性,可将![]() 转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
阳离子 | Fe3+ | Fe2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | —— | —— |
沉淀完全时的pH | 3.2 | 9.0 | 9(>9溶解) | 8 |
(1)某含铬废水处理的主要流程如下图所示:

①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)______________________________。
②请补充并配平以下反应池中发生主要反应的离子方程式:____![]() +____
+____![]() +____===____Cr3++____
+____===____Cr3++____![]() +____H2O。
+____H2O。
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-===H2O和_______________________________。证明Cr3+沉淀完全的方法是_____________________________________________________________。
(2)工业可用电解法来处理含![]() 的废水。实验室利用如图模拟处理含
的废水。实验室利用如图模拟处理含![]() 的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。
的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。

①Fe2+与酸性溶液中的![]() 反应的离子方程式是______________________________。
反应的离子方程式是______________________________。
② 若溶液中含有0.01 mol ![]() ,则阳离子全部生成的沉淀的物质的量是______mol。
,则阳离子全部生成的沉淀的物质的量是______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com