
【题目】可用如图装置制取、净化、收集气体的是
选项 | 气体 | ① | ② | ③ |
|
A | NH3 | 浓氨水 | 生石灰 | 浓硫酸 | |
B | SO2 | 浓硫酸 | Na2SO3 | 浓硫酸 | |
C | NO2 | 浓硝酸 | 铜屑 | H2O | |
D | Cl2 | 浓盐酸 | MnO2 | H2O |
A. A B. B C. C D. D
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,然后打开止水夹,下列与实验事实相符的是

A. NH3(H2O含紫色石蕊试液),红色喷泉
B. SO2(NaOH溶液),无色喷泉
C. HCl(H2O含紫色石蕊试液),蓝色喷泉
D. NO(NaOH溶液),无色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种元素,已知5.75 g A单质跟盐酸完全反应,在标准状况下产生2.8L氢气和 0.25 mol ACln;B的气态氢化物的分子式为 H2B,其相对分子质量与B的最高价氧化物的水化物相对分子质量之比为1: 2.88,B原子核内质子数与中子数相等;C和B可形成液态化合物 CB2,并能溶解B的单质。试回答下列问题:
(1)A、B、C的名称分别是______、______、________;
(2) A离子的结构示意图为_______; B在周期表中的位置为_______;CB2的分子式为_______。
(3)A与B形成的化合物的化学式为_________
(4)B的最高价氧化物的水化物的化学式为_________,
(5)写出B的气态氢化物与B的低价氧化物反应生成淡黄色固体的化学方程式:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预测原子序数为114的元素,具有相当稳定性的同位素,它的位置在第7周期IVA族,称为类铅。关于它的性质,预测错误的是
A.它的最外层电子数为4B.它的金属性比铅强
C.它具有+2、+3、+4价D.它的最高价氧化物的水化物是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
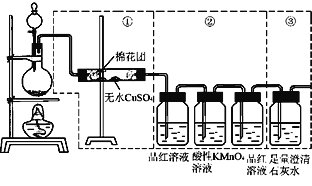
(1)浓硫酸与木炭粉在加热条件下的化学方程式为________________。
(2)如果装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检验出的物质是________________;不能检出的物质是____________。
(3)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是_____________;不能检出的物质是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 人类历史上使用最早的合金是青铜
B. 钢属于铁合金
C. 目前世界上使用量最大的合金是铝合金
D. 目前世界上用途最广的是合金钢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学教材中元素周期表的一部分,其中标出A~Q14种元素,试回答下列问题:

(1)在上表所列出的短周期元素中
①性质最不活泼的是____________;②原子半径最大的是(除稀有气体元素)__________。
③形成的气态氢化物最稳定的是______________________________;
④最高价氧化物对应的水化物中酸性最强的是____________碱性最强的是_____________。
⑤形成的阴离子还原性最弱的是_____________,阳离子半径最小的是_____________。
(2)①B的气态氢化物与最高价氧化物对应的水化物发生反应的化学方程式为________________;
②A单质与J的最高价氧化物对应的水化物反应的方程式________________________________。
(3)设P的原子序数为Z,则F的原子序数为______________,Q的原子序数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如图:

已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有________________(任写一种)。
(2)调节浸出液pH的范围为________,其目的是____________________。
(3)本工艺中可循环使用的物质是________(写化学式)。
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成__________的结果。
Ⅱ.海水开发利用的部分过程如下图所示。

(1)海水中提取的NaCl中若混有少量的KClO3固体(KClO3溶解度随温度变化大),可通过______、________、_________的操作净化。
(2)生成Mg(OH)2用的沉淀剂一般是生石灰或熟石灰,所以Mg(OH)2沉淀中会混有Ca(OH)2,可通过反复洗涤去除Ca(OH)2,检验沉淀是否洗净的操作方法_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各数值表示元素原子序数,在各组中能以离子键相互结合成稳定化合物的是( )
A. 10和19 B. 6和16 C. 11和17 D. 14和8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com