
【题目】某100mL溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种,取该溶液进行连续实验,实验过程如图所示
中的若干种,取该溶液进行连续实验,实验过程如图所示![]() 所加试剂均过量,气体全部逸出
所加试剂均过量,气体全部逸出![]()

下列说法一定正确的是![]()
A.溶液中一定含有![]() ,
,![]() 浓度是
浓度是![]()
B.溶液中只有![]() 、
、![]() 、
、![]() 离子
离子
C.溶液中可能含有![]() ,一定没有
,一定没有![]()
D.取原溶液少许加入硝酸酸化的![]() 溶液检验是否有
溶液检验是否有![]()
【答案】C
【解析】
加入氯化钡溶液,生成沉淀,一定含有碳酸根或是硫酸根中的至少一种,则该沉淀为![]() 、
、![]() 中的至少一种,沉淀部分溶解于盐酸,所以一定是
中的至少一种,沉淀部分溶解于盐酸,所以一定是![]() 、
、![]() 的混合物,一定存在
的混合物,一定存在![]() 、
、![]() ,硫酸钡沉淀是
,硫酸钡沉淀是![]() ,物质的量是
,物质的量是![]() ,碳酸根离子的物质的量是
,碳酸根离子的物质的量是![]() ,碳酸根和铁离子不共存,一定不存在
,碳酸根和铁离子不共存,一定不存在![]() ,所得到的滤液中加入氢氧化钠,出现气体,为氨气,一定含有铵根离子,根据元素守恒,铵根离子的物质的量是
,所得到的滤液中加入氢氧化钠,出现气体,为氨气,一定含有铵根离子,根据元素守恒,铵根离子的物质的量是![]() ,则阳离子为铵根离子,所带正电荷的物质的量为
,则阳离子为铵根离子,所带正电荷的物质的量为![]() ,阴离子所带负电荷的物质的量之和
,阴离子所带负电荷的物质的量之和![]() ,所以一定存在钠离子,氯离子不能确定,
,所以一定存在钠离子,氯离子不能确定,![]() ,所以
,所以![]() ,以此解答该题。
,以此解答该题。
![]() 由以上分析可知原溶液一定含有
由以上分析可知原溶液一定含有![]() ,
,![]() ,选项A错误;
,选项A错误;
B.由以上分析可知,原溶液一定含![]() 、
、![]() 、
、![]() 、
、![]() ,可能存在
,可能存在![]() ,一定没有
,一定没有![]() ,选项B错误;
,选项B错误;
C.由以上分析可知,原溶液一定含![]() 、
、![]() 、
、![]() 、
、![]() ,可能存在
,可能存在![]() ,一定没有
,一定没有![]() ,选项C正确;
,选项C正确;
D.因为原溶液一定含![]() 、
、![]() ,则加入硝酸酸化的
,则加入硝酸酸化的![]() 溶液一定会生成白色沉淀,则不能确定是否有
溶液一定会生成白色沉淀,则不能确定是否有![]() ,选项D错误。
,选项D错误。
答案选C。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
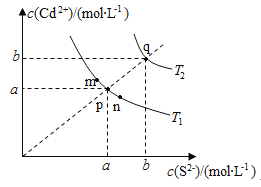
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种均可溶于水的固体物质,是由以下提供的几种离子组成![]() 每种离子只能用一次
每种离子只能用一次![]() :
:
阳离子 |
|
阴离子 |
|
现分别进行如下实验:
![]() 将D与E的溶液混合加热,产生有刺激性气味的气体
将D与E的溶液混合加热,产生有刺激性气味的气体
![]() 将B与E的溶液混合,产生白色沉淀,向该沉淀中加入足量的稀硝酸,沉淀部分溶解
将B与E的溶液混合,产生白色沉淀,向该沉淀中加入足量的稀硝酸,沉淀部分溶解
![]() 在常温下用pH试纸测定溶液A的
在常温下用pH试纸测定溶液A的![]()
下列说法不正确的是![]()
A.物质E的化学式为![]() B.物质D中一定含有
B.物质D中一定含有![]()
C.难以确定物质A的组成D.物质C的化学式是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题。
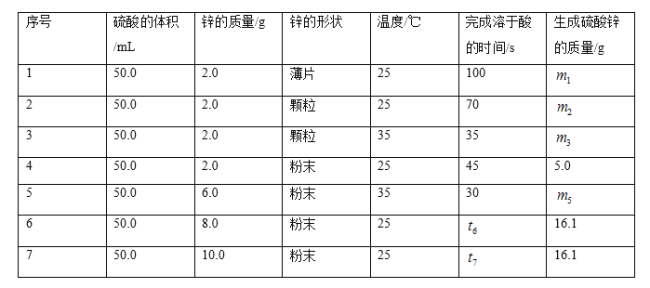
(1)化学反应速率本质上是由_____________ 决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3表明_____________ 对反应速率有影响,该因素对反应速率的具体影响是其他条件相同时,_____________反应速率越快。
(2)我们选取实验_____________(填实验序号)研究锌的形状对反应速率的影响。我们发现在其他条件相同时,反应物间的_____________反应速率越快。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少硫酸铜溶液,发现反应速率明显加快,原因是 _____________。
(4)利用表中数据,可以求出硫酸的物质的量浓度是_____________![]() (计算结果精确到小数点后一位)。
(计算结果精确到小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热的恒容密闭容器中,可逆反应![]() 达到平衡状态的标志是( )
达到平衡状态的标志是( )
①![]() ②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥
②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥![]() ⑦3mol H-H键断裂的同时有2mol N-H键也断裂
⑦3mol H-H键断裂的同时有2mol N-H键也断裂
A.①②③⑤⑥B.②③④⑤⑥
C.②③⑤⑥D.②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
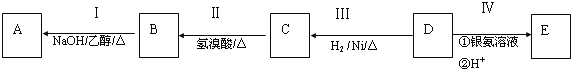
【题目】有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如图所示,其中B、D、E的结构中均含有2个![]() ,它们的核磁共振氢谱中均出现4个峰.
,它们的核磁共振氢谱中均出现4个峰.
请回答:
![]() 中所含官能团的名称为______;D的分子式为______;
中所含官能团的名称为______;D的分子式为______;
![]() Ⅲ的反应类型为______
Ⅲ的反应类型为______![]() 填字母序号
填字母序号![]() ;
;
![]() 还原反应
还原反应![]() 加成反应
加成反应![]() 氧化反应
氧化反应![]() 消去反应
消去反应
![]() 写出下列反应的化学方程式:
写出下列反应的化学方程式:
Ⅰ:______;
Ⅱ:______;
![]() 和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为______;
和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为______;
![]() 的同分异构体中有一对互为顺反异构,且结构中有2个
的同分异构体中有一对互为顺反异构,且结构中有2个![]() ,它们的结构简式为______和______;
,它们的结构简式为______和______;
![]() 的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为______。
的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符合如图的反应是( )
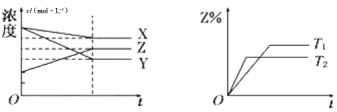
A.X(g)+3Y(g)![]() 2Z(g) ΔH>0
2Z(g) ΔH>0
B.X(g)+3Y(g)![]() 2Z(g) ΔH<0
2Z(g) ΔH<0
C.X(g)+2Y(g)![]() 3Z(g) ΔH<0
3Z(g) ΔH<0
D.X(g)+2Y(g)![]() 3Z(g) ΔH>0
3Z(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列溶液的有关计算。
(1)某H2SO4溶液的浓度是0.005molL-1;
①此溶液的pH=___;
②该溶液中由水电离的c(H+)为___。
③用水稀释到原来体积的100倍,pH=___。
(2)0.001mol/L的NaOH溶液, pH=___;
(3)0.015mol/L的H2SO4与0.01mol/L的NaOH等体积混合,混合液pH=___。
(4)把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则两种溶液的体积比应是___。
A.10∶1 B.1∶10 C.1∶100 D.1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·武汉市高中毕业生五月模拟考试)草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下::
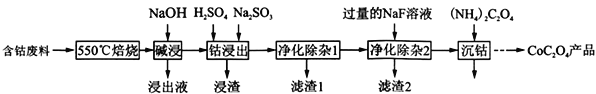
(1) “550℃焙烧”的目的是______________________;
(2)“浸出液”的主要成分是_____________________;
(3) “钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_____________________;
(4) “净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是___________________________(用离子方程式表示);再升温至80 ~ 85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是_____________________。
(5) “净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l05mol /L,则滤液中 c(Mg2+)为______________ [已知Ksp(MgF2) =7.35×1011、Ksp(CaF2) =1.05×1010]。
(6)为测定制得样品的纯度,现称取1.00 g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0. 1000 mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00 mL,则草酸钴样品的纯度为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com