
【题目】25℃时,下列溶液的有关计算。
(1)某H2SO4溶液的浓度是0.005molL-1;
①此溶液的pH=___;
②该溶液中由水电离的c(H+)为___。
③用水稀释到原来体积的100倍,pH=___。
(2)0.001mol/L的NaOH溶液, pH=___;
(3)0.015mol/L的H2SO4与0.01mol/L的NaOH等体积混合,混合液pH=___。
(4)把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则两种溶液的体积比应是___。
A.10∶1 B.1∶10 C.1∶100 D.1∶2
【答案】2 1×10-12mol·L-1 4 11 2 B
【解析】
先求溶液中氢离子浓度,再求pH值,再求溶液中氢氧根离子就等于水电离出的氢离子,稀释10n倍,pH变化n个单位;碱溶液先求氢氧根离子浓度,再求氢离子浓度,再求pH值,酸碱混合,先看谁过量再求谁,酸碱混合呈中性,建立酸中氢离子物质的量等于碱中氢氧根的物质的量。
⑴某H2SO4溶液的浓度是0.005molL-1;
①c(H+) = 2c(H2SO4)=2×0.005molL-1 = 0.01 molL-1,pH = -lgc(H+) = -lg0.01 = 2;
②c(H+) = 0.01 molL-1,![]() ,
,![]()
③用水稀释到原来体积的100倍,氢离子浓度变为原来的百分之一,即c(H+)=1×10-4 mol·L-1,pH = -lgc(H+) = -lg1×10-4 = 4;
故答案为:2;1×10-12mol·L-1;4;
⑵0.001mol/L的NaOH溶液,![]() ,pH = -lgc(H+) = -lg1×10-11 = 11;
,pH = -lgc(H+) = -lg1×10-11 = 11;
故答案为:11;
⑶0.015mol/L的H2SO4,c(H+) = 2c(H2SO4)=2×0.015molL-1 = 0.03 molL-1,0.01mol/L的NaOH,c(OH-) = 0.01 molL-1,等体积混合,![]() ,pH = -lgc(H+) = -lg0.01 = 2;
,pH = -lgc(H+) = -lg0.01 = 2;
故答案为:2;
⑷把pH=3的H2SO4溶液c(H+) = 1×10-3 molL-1,和pH=10的NaOH溶液c(OH-) = 1×10-4 molL-1,混合,两者恰好中和,酸的体积为V(酸)、碱的体积为V(碱),![]() ,
,![]() ,故B正确;
,故B正确;
综上所述,答案为B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05mg·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
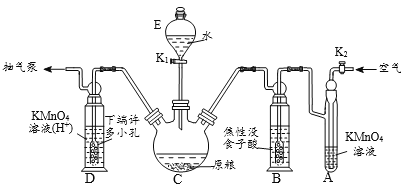
【操作流程】安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
【实验装置】C中盛100 g原粮,D中盛有 20.00 mL 1.12×10-4 mol L-1KMnO4溶(H2SO4酸化)。
请回答下列问题:
(1)仪器C的名称是_________;原粮最好先打成粉末,其原因是_____________。
(2)磷化钙与水反应有化学方程式为_____________________________________;检查整套装置气密性良好的方法是_______________________________________。
(3)A中盛装KMnO4溶液的作用是除去空气中的还原性气体;B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止___________;通入空气的作用是____________。
(4)D中PH3被氧化成磷酸,所发生反应的离子方程式为_________________________。
(5)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5mol L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗标Na2SO3准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为______mg kg-1,该原粮质量________(填“合格”或“不合格”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种,取该溶液进行连续实验,实验过程如图所示
中的若干种,取该溶液进行连续实验,实验过程如图所示![]() 所加试剂均过量,气体全部逸出
所加试剂均过量,气体全部逸出![]()

下列说法一定正确的是![]()
A.溶液中一定含有![]() ,
,![]() 浓度是
浓度是![]()
B.溶液中只有![]() 、
、![]() 、
、![]() 离子
离子
C.溶液中可能含有![]() ,一定没有
,一定没有![]()
D.取原溶液少许加入硝酸酸化的![]() 溶液检验是否有
溶液检验是否有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25℃时,欲使醋酸溶液pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳。核黄素分子的结构为:

已知:
有关核黄素的下列说法中,不正确的是:
A.该化合物的分子式为C17H22N4O6
B.酸性条件下加热水解,有CO2生成
C.酸性条件下加热水解,所得溶液加碱后有NH3生成
D.能发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中只可能溶有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子中的几种离子。为分析其组成,现进行如下实验:
等离子中的几种离子。为分析其组成,现进行如下实验:
![]() 取10mL该溶液于试管中滴加足量的
取10mL该溶液于试管中滴加足量的![]() 溶液,加稀硝酸酸化后过滤得到
溶液,加稀硝酸酸化后过滤得到![]() 白色沉淀甲.
白色沉淀甲.
![]() 取上述反应后的滤液,加入
取上述反应后的滤液,加入![]() 溶液未见沉淀产生.
溶液未见沉淀产生.
![]() 另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为
另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为![]() 时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为
时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为![]() 假设丙全部逸出
假设丙全部逸出![]() ,最后沉淀完全溶解。
,最后沉淀完全溶解。
下列推断正确的是![]()
A.肯定有![]() 、
、![]() 、
、![]() 、
、![]()
B.肯定有![]() 、
、![]() 、
、![]()
C.肯定没有![]() 、
、![]() 、
、![]()
D.肯定没有![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。
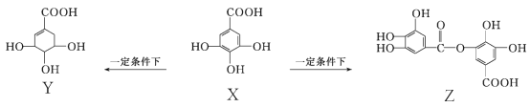
下列说法错误的是
A. 1 mol Z最多能与8 mol NaOH发生反应
B. 1 mol X与H2完全加成产物的分子式为C7H12O5
C. 向Y中滴加FeCl3溶液呈紫色
D. 1 mol Y与足量的金属钠反应放出2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是表面分子、药物的中间体,N是一种高分子化合物。实验室由A、B两种烃制备M和N一种合成路线如下: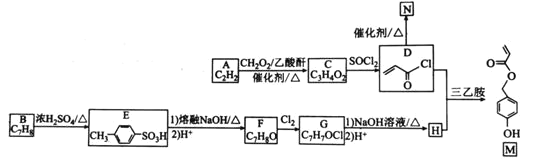
已知:![]()
回答下列问题:
(1)B的化学名称为________。N的结构简式为_____________________。
(2)由A生成C的反应类型为____。G中官能团的名称为______________。
(3)由F转化为G的条件为________________________________。
(4)由D和H生成M的化学方程式为_________________________。
(5)![]() 是M的同分异构体,同时满足下列条件的X的结构有_________种。
是M的同分异构体,同时满足下列条件的X的结构有_________种。
①能与![]() 溶液发生显色反应
溶液发生显色反应
②能发生银镜反应,且![]() 最多生成
最多生成![]()
③核磁共振氢谱中有5组吸收峰
(6)参照上述合成路线和信息,设计以苯和甲醛为原料制备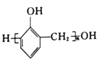 的合成路线
的合成路线![]() 无机试剂任选
无机试剂任选![]() :________________________________。
:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com