
【题目】有机物M是表面分子、药物的中间体,N是一种高分子化合物。实验室由A、B两种烃制备M和N一种合成路线如下: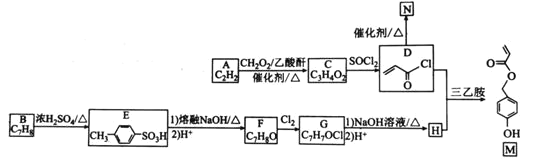
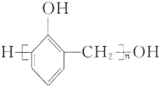
已知:![]()
回答下列问题:
(1)B的化学名称为________。N的结构简式为_____________________。
(2)由A生成C的反应类型为____。G中官能团的名称为______________。
(3)由F转化为G的条件为________________________________。
(4)由D和H生成M的化学方程式为_________________________。
(5)![]() 是M的同分异构体,同时满足下列条件的X的结构有_________种。
是M的同分异构体,同时满足下列条件的X的结构有_________种。
①能与![]() 溶液发生显色反应
溶液发生显色反应
②能发生银镜反应,且![]() 最多生成
最多生成![]()
③核磁共振氢谱中有5组吸收峰
(6)参照上述合成路线和信息,设计以苯和甲醛为原料制备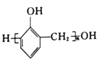 的合成路线
的合成路线![]() 无机试剂任选
无机试剂任选![]() :________________________________。
:________________________________。
【答案】甲苯 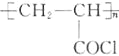 加成反应 氯原子、
加成反应 氯原子、![]() 酚
酚![]() 羟基 光照
羟基 光照 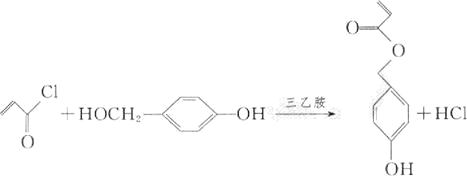
![]()
![]()
【解析】
A只能是乙炔,根据分子式和E的结构不难推出B为甲苯,C是丙烯酸,F为对甲基苯酚,G为侧链上的氢原子被氯原子取代后的产物,而G在碱的水溶液中水解可以形成醇H,H和D发生取代反应即可得到产物M。
(1)由E的结构简式可推出,B发生磺化反应生成E,则B的化学名称为:甲苯,D发生加成反应得到N,N的结构简式为: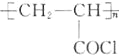 ;
;
(2)A(![]() )与
)与![]() 的分子式相加刚好得到C的分子式
的分子式相加刚好得到C的分子式![]() ,故反应类型为加成反应,由E可得F应为对甲基苯酚,G为F中甲基上一个氢原子被氯原子取代的产物,故G中官能团的名称为:氯原子、酚羟基;
,故反应类型为加成反应,由E可得F应为对甲基苯酚,G为F中甲基上一个氢原子被氯原子取代的产物,故G中官能团的名称为:氯原子、酚羟基;
(3)G为F中甲基上一个氢原子被氯原子取代的产物,由F转化为G是与![]() 的取代反应,故条件为光照;
的取代反应,故条件为光照;
(4)由D和H生成M的化学方程式为: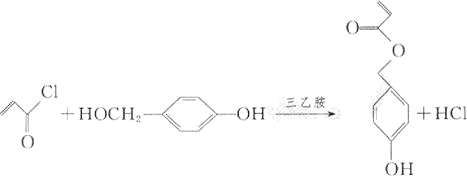 ;
;
(5)X是M的同分异构体,①能与![]() 溶液发生显色反应,说明含有酚羟基,②能发生银镜反应,1molX最多生成4molAg,说明有两个醛基,③核磁共振氢谱中有5组吸收峰,说明有5个等效氢,故同时满足以上条件的X的结构有5种,分别为:
溶液发生显色反应,说明含有酚羟基,②能发生银镜反应,1molX最多生成4molAg,说明有两个醛基,③核磁共振氢谱中有5组吸收峰,说明有5个等效氢,故同时满足以上条件的X的结构有5种,分别为: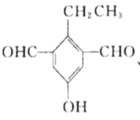 、
、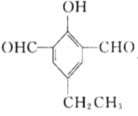 、
、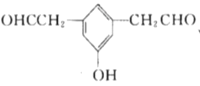 、
、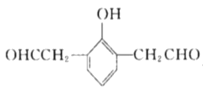 、
、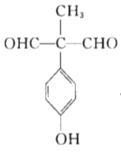 ,故答案为5;
,故答案为5;
(6)参照上述合成路线和信息,设计以苯和甲醛为原料![]() 无机试剂任选
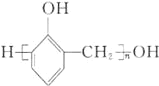
无机试剂任选![]() ,制备
,制备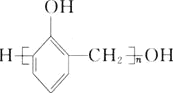 的合成路线:
的合成路线:![]()
 。
。


科目:高中化学 来源: 题型:
【题目】25℃时,下列溶液的有关计算。
(1)某H2SO4溶液的浓度是0.005molL-1;
①此溶液的pH=___;
②该溶液中由水电离的c(H+)为___。
③用水稀释到原来体积的100倍,pH=___。
(2)0.001mol/L的NaOH溶液, pH=___;
(3)0.015mol/L的H2SO4与0.01mol/L的NaOH等体积混合,混合液pH=___。
(4)把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则两种溶液的体积比应是___。
A.10∶1 B.1∶10 C.1∶100 D.1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·武汉市高中毕业生五月模拟考试)草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下::
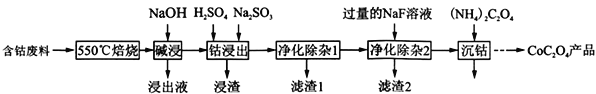
(1) “550℃焙烧”的目的是______________________;
(2)“浸出液”的主要成分是_____________________;
(3) “钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_____________________;
(4) “净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是___________________________(用离子方程式表示);再升温至80 ~ 85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是_____________________。
(5) “净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l05mol /L,则滤液中 c(Mg2+)为______________ [已知Ksp(MgF2) =7.35×1011、Ksp(CaF2) =1.05×1010]。
(6)为测定制得样品的纯度,现称取1.00 g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0. 1000 mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00 mL,则草酸钴样品的纯度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以旋转,结构简式为 ![]() 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A. 分子中最多有6个碳原子处于同一直线上
B. 该烃苯环上的一氯代物有3种
C. 分子中至少有12个碳原子处于同一平面上
D. 该烃属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)△H=+100kJ/mol的能量变化如图所示,判断下列叙述中正确的是
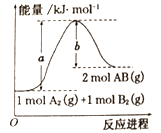
A. 加入催化剂,该反应的反应热△H将减小
B. 每生成2molA-B键,将吸收bkJ能量
C. 每生成2分子AB吸收(a-b)kJ能量
D. 该反应正反应的活化能大于100kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含绒量是决定羽绒服质量优劣最重要的指标,按照我国实施的羽绒服新国标,羽绒服的含绒量要在50%以上,一些不法厂家填充“飞丝”或“人造羊毛来假冒羽绒,严重损害消费者的利益。“飞丝”由鸭毛、鹅毛甚至鸡毛经粉碎而成,人造羊毛的主要成分是聚丙烯腈纤维。请回答下列问题:
Ⅰ.鸭绒、蚕丝、人造羊毛都是高分子化合物,下列说法正确的是________(填序号)。
A.通过灼烧的方法可鉴别羽绒服中填充的是鸭绒还是飞丝
B.将人造羊毛和棉花进行混纺可提高纤维的性能
C.鸭绒、蚕丝、人造羊毛都有固定的熔沸点
D.鸭绒、蚕丝、人造羊毛燃烧过程中不会产生有毒气体
Ⅱ.合成聚丙烯腈纤维的方法很多,如以乙炔为原料,其合成过程如下:
CH≡CH+HCN![]() CH2=CHCN
CH2=CHCN![]() 聚丙烯腈
聚丙烯腈
(1)反应①的反应类型为__________。
(2)写出反应②的化学方程式:__________________,其反应类型为_________。
(3)CH2=CHCN在一定条件下可与苯乙烯(![]() )反应得到一种优良的塑料,该塑料的结构简式为__________。
)反应得到一种优良的塑料,该塑料的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次递增的前四周期元素。A是宇宙中含量最丰富的元素;D与E同主族,且E的原子序数是D的两倍;B与D组成的化合物是一种温室气体;C元素原子最外层P能级比S能级多1个电子;F原子的最外层电子数与A相同,其余各层均充满。据此回答下列问题。
(1)F元素形成的高价基态离子的核外电子排布式为__________。
(2)E的一种具有强还原性的氧化物分子的VSEPR模型为__________。
(3)C、D、E元素的第一电离能由大到小的顺序是__________。(用元素符号表示)
(4)A和D形成的18电子化合物难溶于BE2,其理由是__________,此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为__________
(5)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是__________。
(6)F与C形成化合物的晶胞如图所示,该化合物的化学式为_____________,C离子的配位数是_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K4[Fe(CN)6]可用作食盐的抗结剂,高温下K4[Fe(CN)6]会分解生成(CN)2、KCN、N2、Fe3C、C等物质。
(1)基态铁原子的价电子排布式为___;上述物质中涉及的几种元素的第一电离能由大到小的顺序为___;[Fe(CN)6]4-中,铁提供的空轨道数目是___。
(2)(CN)2分子中存在碳碳键,则(CN)2的立体构型是__,分子中σ键与π键数目之比为___;KCN与盐酸作用可形成HCN,HCN的中心原子的杂化轨道类型为___。
(3)已知Fe3C的晶胞结构中碳原子的配位数为6,与碳原子紧邻的铁原子的空间构型为___,铁原子的配位数是___。
(4)碳元素可形成多种结构和性质不同的单质,其中金刚石的熔点为3550℃,C60的熔点约为280℃,导致这种差异的原因是___。
(5)铁、镍位于同一族,若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为___。一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图2),已知O2-的半径为am,每平方米面积上分散的该晶体的质量为___g。(用a、NA表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙烯分子里含有一个碳碳双键的事实是( )
A.乙烯分子里碳氢原子个数之比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯能使酸性KMnO4溶液褪色
D.乙烯易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com