
【题目】K4[Fe(CN)6]可用作食盐的抗结剂,高温下K4[Fe(CN)6]会分解生成(CN)2、KCN、N2、Fe3C、C等物质。
(1)基态铁原子的价电子排布式为___;上述物质中涉及的几种元素的第一电离能由大到小的顺序为___;[Fe(CN)6]4-中,铁提供的空轨道数目是___。
(2)(CN)2分子中存在碳碳键,则(CN)2的立体构型是__,分子中σ键与π键数目之比为___;KCN与盐酸作用可形成HCN,HCN的中心原子的杂化轨道类型为___。
(3)已知Fe3C的晶胞结构中碳原子的配位数为6,与碳原子紧邻的铁原子的空间构型为___,铁原子的配位数是___。
(4)碳元素可形成多种结构和性质不同的单质,其中金刚石的熔点为3550℃,C60的熔点约为280℃,导致这种差异的原因是___。
(5)铁、镍位于同一族,若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为___。一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图2),已知O2-的半径为am,每平方米面积上分散的该晶体的质量为___g。(用a、NA表示)

【答案】3d64s2 N>C>Fe>K 6 直线形 3:4 sp 正八面体 2 金刚石是原子晶体,C60是分子晶体,前者原子间是靠强烈的共价键结合的,后者分子间是靠微弱的范德华力结合在一起的 (1,0.5,0.5) ![]()
【解析】
(1)Fe原子核外电子排布式为![]() ;IIA、VA族为全充满或半充满稳定状态,第一电离能高于同周期相邻元素;
;IIA、VA族为全充满或半充满稳定状态,第一电离能高于同周期相邻元素;![]() 与
与![]() 形成6个配位键;
形成6个配位键;
(2)(CN)2分子中存在碳碳键,结构式为![]() ,HCN结构式为
,HCN结构式为![]() ;
;
(3)Fe3C的晶胞结构中,以C原子为原点建立三维坐标系,Fe原子位于坐标轴上且关于原点![]() 碳原子
碳原子![]() 对称,6个Fe形成的空间结构为正八面体;配位数之比等于相应原子数目反比;
对称,6个Fe形成的空间结构为正八面体;配位数之比等于相应原子数目反比;
(4)金刚石是原子晶体,![]() 是分子晶体;
是分子晶体;
(5)由A、B参数,可知A处于坐标系的原点,晶胞中含有A原子的3个棱分别为坐标系的x、y、z轴,C为与晶胞右侧面,C到晶胞左侧面距离为参数x,到晶胞前平面距离为参数y,到晶胞下底面距离为参数z;由质量公式计算可得。
(1)Fe原子核外电子排布式为![]() ,处于过渡元素,除最外层外价电子还包含3d电子,故价电子排布式为:
,处于过渡元素,除最外层外价电子还包含3d电子,故价电子排布式为:![]() ;一般金属性越强第一电离能越小,同周期主族元素随原子序数增大第一电离能呈增大趋势,IIA、VA族为全充满或半充满稳定状态,第一电离能高于同周期相邻元素,故第一电离能:
;一般金属性越强第一电离能越小,同周期主族元素随原子序数增大第一电离能呈增大趋势,IIA、VA族为全充满或半充满稳定状态,第一电离能高于同周期相邻元素,故第一电离能:![]() ;
;![]() 与
与![]() 形成6个配位键,
形成6个配位键,![]() 中铁提供的空轨道数目是6,故答案为:
中铁提供的空轨道数目是6,故答案为:![]() ;
;![]() ;6;
;6;
(2)(CN)2分子中存在碳碳键,结构式为![]() ,C原子为sp杂化,故分子空间构型为:直线形,单键为
,C原子为sp杂化,故分子空间构型为:直线形,单键为![]() 键、三键含有1个
键、三键含有1个![]() 键、2个
键、2个![]() 键,分子中
键,分子中![]() 键与
键与![]() 键数目之比为3:4;HCN结构式为
键数目之比为3:4;HCN结构式为![]() ,中心碳原子的
,中心碳原子的![]() 键电子对数为2,孤电子对数为0,价层电子对数为2,故碳原子的杂化轨道类型为sp杂化,故答案为:直线形;3:4;sp;
键电子对数为2,孤电子对数为0,价层电子对数为2,故碳原子的杂化轨道类型为sp杂化,故答案为:直线形;3:4;sp;
(3)Fe3C的晶胞结构中碳原子的配位数为6,与碳原子紧邻的铁原子,以C原子为原点建立三维坐标系,Fe原子位于坐标轴上且关于原点![]() 碳原子
碳原子![]() 对称,6个Fe形成的空间结构为正八面体,故C原子的配位数为6,配位数之比等于相应原子数目反比,则Fe原子配位数为
对称,6个Fe形成的空间结构为正八面体,故C原子的配位数为6,配位数之比等于相应原子数目反比,则Fe原子配位数为![]() ,故答案为:正八面体;2;
,故答案为:正八面体;2;
(4)金刚石是原子晶体,![]() 是分子晶体,前者原子间是靠强烈的共价键结合的,后者分子间是靠微弱的范德华力结合在一起的,金刚石的熔点比
是分子晶体,前者原子间是靠强烈的共价键结合的,后者分子间是靠微弱的范德华力结合在一起的,金刚石的熔点比![]() 的熔点高,故答案为:金刚石是原子晶体,
的熔点高,故答案为:金刚石是原子晶体,![]() 是分子晶体,前者原子间是靠强烈的共价键结合的,后者分子间是靠微弱的范德华力结合在一起的;
是分子晶体,前者原子间是靠强烈的共价键结合的,后者分子间是靠微弱的范德华力结合在一起的;
(5)由A、B参数,可知A处于坐标系的原点,晶胞中含有A原子的3个棱分别为坐标系的x、y、z轴,C为与晶胞右侧面,C到晶胞左侧面距离为参数x,到晶胞前平面距离为参数y,到晶胞下底面距离为参数z,由B的参数可知晶胞是边长为1的正方体,则C的参数![]() 、
、![]() 、
、![]() ,平面NiO基本结构单元为
,平面NiO基本结构单元为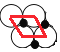 ,重复单元呈平行四边形,每个机构单元含有1个“NiO”,
,重复单元呈平行四边形,每个机构单元含有1个“NiO”,![]() 的半径为am,则结构单元的面积为:
的半径为am,则结构单元的面积为:![]() ,每平方米含有的结构单元数目
,每平方米含有的结构单元数目![]() ,即结构单元含有“NiO“数目,故每平方米面积上分散的该晶体的质量为
,即结构单元含有“NiO“数目,故每平方米面积上分散的该晶体的质量为![]()
![]() ,故答案为:
,故答案为:![]() ;
;![]() 。
。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。
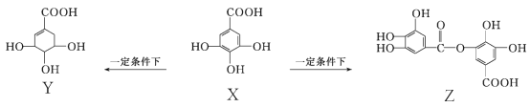
下列说法错误的是
A. 1 mol Z最多能与8 mol NaOH发生反应
B. 1 mol X与H2完全加成产物的分子式为C7H12O5
C. 向Y中滴加FeCl3溶液呈紫色
D. 1 mol Y与足量的金属钠反应放出2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是表面分子、药物的中间体,N是一种高分子化合物。实验室由A、B两种烃制备M和N一种合成路线如下: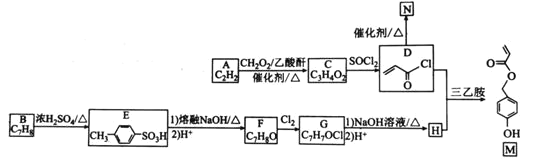
已知:![]()
回答下列问题:
(1)B的化学名称为________。N的结构简式为_____________________。
(2)由A生成C的反应类型为____。G中官能团的名称为______________。
(3)由F转化为G的条件为________________________________。
(4)由D和H生成M的化学方程式为_________________________。
(5)![]() 是M的同分异构体,同时满足下列条件的X的结构有_________种。
是M的同分异构体,同时满足下列条件的X的结构有_________种。
①能与![]() 溶液发生显色反应
溶液发生显色反应
②能发生银镜反应,且![]() 最多生成
最多生成![]()
③核磁共振氢谱中有5组吸收峰
(6)参照上述合成路线和信息,设计以苯和甲醛为原料制备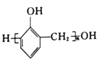 的合成路线
的合成路线![]() 无机试剂任选
无机试剂任选![]() :________________________________。
:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于该物质,下列说法正确的是()
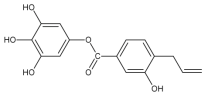
A.1mol该物质最多与8mol H2发生加成反应
B.1mol该物质最多与5mol Br2反应
C.1mol该物质最多与6mol NaOH发生反应
D.可以用酸性高锰酸钾溶液检验该物质中含有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患.
![]() 某锅炉水垢的主要成分有
某锅炉水垢的主要成分有![]() 、
、![]() 、
、![]() 、
、![]() ,用酸洗法可除去该水垢,其基本原理如图1所示.
,用酸洗法可除去该水垢,其基本原理如图1所示.
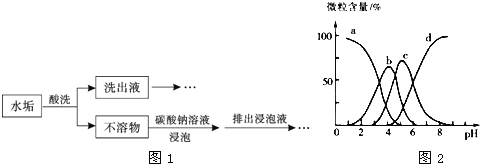
![]() 酸洗时,为使水垢尽可能溶解,不宜选用的是 ______
酸洗时,为使水垢尽可能溶解,不宜选用的是 ______ ![]() 填标号
填标号![]() .
.
A.稀硫酸![]() 盐酸
盐酸![]() 硝酸
硝酸![]() 醋酸
醋酸
![]() 不溶物用碳酸钠溶液浸泡时,反应的离子方程式是 ______ .
不溶物用碳酸钠溶液浸泡时,反应的离子方程式是 ______ .
![]() 洗出液中的
洗出液中的![]() 会腐蚀铁质管道,反应的离子方程式是 ______ ,因此,常在洗出液中加入具有强还原性的
会腐蚀铁质管道,反应的离子方程式是 ______ ,因此,常在洗出液中加入具有强还原性的![]() 溶液,反应中的
溶液,反应中的![]() 与
与![]() 的物质的量之比为1:2,
的物质的量之比为1:2,![]() 转化为
转化为![]() ______
______ ![]() 填离子符号
填离子符号![]() .
.
![]() 柠檬酸
柠檬酸![]() 用
用![]() 表示
表示![]() 可用作酸洗剂,溶液中
可用作酸洗剂,溶液中![]() 、
、![]() 、
、![]() 、
、![]() 的含量与pH的关系如图2所示.图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是 ______
的含量与pH的关系如图2所示.图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是 ______ ![]() 调节柠檬酸溶液的
调节柠檬酸溶液的![]() ,有利于除去水垢中的氧化铁.
,有利于除去水垢中的氧化铁.![]() 时,溶液中上述4种微粒含量最多的是 ______ .
时,溶液中上述4种微粒含量最多的是 ______ .
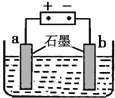
![]() 利用下图所示装置对锅炉水
利用下图所示装置对锅炉水![]() 含
含![]() 、
、![]() 、
、![]() 进行预处理,可有效防止锅炉水垢的形成.电解过程中,
进行预处理,可有效防止锅炉水垢的形成.电解过程中,![]() 、
、![]() 在 ______
在 ______ ![]() 填“a”或“b”
填“a”或“b”![]() 极附近形成沉淀.
极附近形成沉淀.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如下图所示,已知电池反应为:2Li+SO2Cl2═2LiCl+SO2↑;下列叙述中错误的是( )
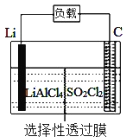
A.电池工作时负极材料是Li,发生氧化反应
B.将电解质溶液改为LiCl的水溶液,电池性能会更好
C.电池工作时电子流向:锂电极→导线→负载→导线→碳棒
D.电池工作过程中,石墨电极反应式为SO2Cl2+2e-═2Cl-+SO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知最简单的有机物E和直线型分子G在光照条件下反应,生成四面体型分子L和直线型分子M(组成G分子的元素为第三周期的元素),如下图。则下列判断错误的是
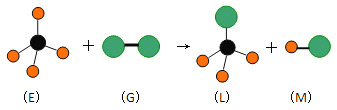
A. 常温常压下,E是一种无色无味的气体
B. 上述反应类型是加成反应
C. 在光照条件L能与 G继续发生与上述类似的反应
D. 上述反应类型是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应:aA(g)+bB(g)![]() cC(g)。其他条件不变时,改变某一条件对上述反应的影响,得到下列图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。下列分析正确的是
cC(g)。其他条件不变时,改变某一条件对上述反应的影响,得到下列图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。下列分析正确的是
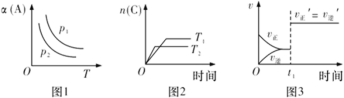
A.如图1反应:若p1>p2,则该反应只能在高温下自发进行
B.如图2反应:此反应的△H<0,且T1>T2
C.如图3反应:表示t1时刻可能是使用催化剂对反应速率的影响
D.如图3反应:表示t1时刻增大B的浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4 是二元弱酸,常温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-4下列溶液的离子浓度关系式正确的是
A.pH=2的H2C2O4溶液中,c(H+)=c(HC2O4-)=10-2mol/L
B.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
C.将NaOH溶液滴加到H2C2O4溶液中至混合溶液呈中性:c(C2O42-)>c(HC2O4-)
D.NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com