
【题目】H2C2O4 是二元弱酸,常温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-4下列溶液的离子浓度关系式正确的是
A.pH=2的H2C2O4溶液中,c(H+)=c(HC2O4-)=10-2mol/L
B.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
C.将NaOH溶液滴加到H2C2O4溶液中至混合溶液呈中性:c(C2O42-)>c(HC2O4-)
D.NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
【答案】C
【解析】
A. H2C2O4 是二元弱酸,pH=2,则c(H+)=10-2mol/L,草酸的二级电离也产生氢离子,则c(H+)>c(HC2O4-);
B.根据溶液呈电中性,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2 c(C2O42-);
C. 混合溶液呈中性,则c(H+)=c(OH-),根据溶液呈电中性,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2 c(C2O42-),可得c(Na+)= c(HC2O4-)+2 c(C2O42-),Ka2(H2C2O4)=5.4×10-4,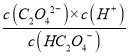 =5.4×10-4则c(C2O42-)>c(HC2O4-);
=5.4×10-4则c(C2O42-)>c(HC2O4-);
D.水解常数=![]() =
=![]() <5.4×10-2,电离程度大于水解程度,则c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)。
<5.4×10-2,电离程度大于水解程度,则c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)。
A. H2C2O4 是二元弱酸,pH=2,则c(H+)=10-2mol/L,草酸的二级电离也产生氢离子,则c(H+)>c(HC2O4-),A错误;
B.根据溶液呈电中性,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2 c(C2O42-),B错误;
C. 混合溶液呈中性,则c(H+)=c(OH-),根据溶液呈电中性,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2 c(C2O42-),可得c(Na+)= c(HC2O4-)+2 c(C2O42-),Ka2(H2C2O4)=5.4×10-4, 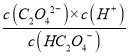 =5.4×10-4则c(C2O42-)>c(HC2O4-),C正确;
=5.4×10-4则c(C2O42-)>c(HC2O4-),C正确;
D.水解常数==![]() =
=![]() <5.4×10-2,电离程度大于水解程度,则c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),D错误;
<5.4×10-2,电离程度大于水解程度,则c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),D错误;
答案为C。


科目:高中化学 来源: 题型:
【题目】K4[Fe(CN)6]可用作食盐的抗结剂,高温下K4[Fe(CN)6]会分解生成(CN)2、KCN、N2、Fe3C、C等物质。
(1)基态铁原子的价电子排布式为___;上述物质中涉及的几种元素的第一电离能由大到小的顺序为___;[Fe(CN)6]4-中,铁提供的空轨道数目是___。
(2)(CN)2分子中存在碳碳键,则(CN)2的立体构型是__,分子中σ键与π键数目之比为___;KCN与盐酸作用可形成HCN,HCN的中心原子的杂化轨道类型为___。
(3)已知Fe3C的晶胞结构中碳原子的配位数为6,与碳原子紧邻的铁原子的空间构型为___,铁原子的配位数是___。
(4)碳元素可形成多种结构和性质不同的单质,其中金刚石的熔点为3550℃,C60的熔点约为280℃,导致这种差异的原因是___。
(5)铁、镍位于同一族,若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为___。一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图2),已知O2-的半径为am,每平方米面积上分散的该晶体的质量为___g。(用a、NA表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙烯分子里含有一个碳碳双键的事实是( )
A.乙烯分子里碳氢原子个数之比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯能使酸性KMnO4溶液褪色
D.乙烯易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则下列说法正确的是( )

A.电源B极是正极
B.(甲)(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在水的电离平衡中,c(H+)和 c(OH-)的关系如图所示:
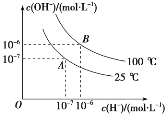
(1)100 ℃时,若向水中滴加盐酸,___(填“能”或“不能”)使体系处于 B 点状态。
(2)25 ℃时,将 pH=9 的 NaOH 溶液与 pH=4 的硫酸溶液混合,所得混合溶液的 pH=7,则 NaOH 溶液与硫酸溶液的体积比为___。
(3)100 ℃时,若盐酸中c(H+)=5×10-5 mol·L-1,则由水电离产生的 c(H+)=____。
Ⅱ、已知在 25 ℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为醋酸K=1.75×10-5,次氯酸 K=2.95×10-8,碳酸 K1=4.30×10-7 ,K2=5.61×10-11,亚硫酸K1=1.54×10-2,K2=1.02×10-7
(4)写出碳酸的第一级电离平衡常数表达式K1=___。
(5)在相同条件下,等浓度的 CH3COONa、NaClO、Na2CO3、NaHCO3、Na2SO3 和 NaHSO3 溶液中碱性最强的是_____。等浓度的 Na2CO3 和 NaHCO3 的混合溶液中各离子浓度大小顺序为______。
(6)若保持温度不变,在醋酸溶液中通入少量 HCl(g),下列量会变小的是_____(填字母序号,下同)。
a.c(CH3COO-) b.c(H+) c.醋酸的电离平衡常数 d.c(CH3COOH)
(7)下列离子方程式中错误的是_____。
a 少量 CO2 通入次氯酸钠溶液中:CO2+H2O+ClO-=HCO![]() +HClO
+HClO
b 少量 SO2 通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
c 过量 CO2 通入澄清石灰水中:CO2+OH-=HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯(CH2=CHCH3)的结构或性质不正确的是( )
A.能使溴水褪色
B.与HCl在一定条件下加成只得到一种产物
C.最多有7个原子在同一平面上
D.在空气中燃烧时火焰明亮并伴有黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将下列装置按如图连接,C、D、E、F、X、Y都是惰性电极,甲、乙、丙 中电解质溶液含溶质均为 1 mol。将电源接通后,向乙中滴入酚酞溶液,在 F 极附近显红色。
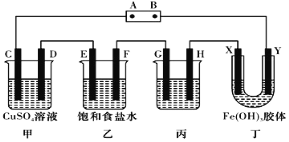
试回答下列问题:
(1)电源 A 极的名称是 ________。
(2)当电路中通过 4 mole-时,要使甲中溶液种类和浓度均复原,可向电解后溶液中加入__________(填某一种物质的化学式和物质的量)。
(3)乙装置中电解反应的总化学方程式为 __________________ 。
(4)若要在丙装置中实现铁器上镀银,银在 _____(填 G 或 H)级。
(5)装置丁中的现象是 _________________________。
(6)若电源用碱性氢氧燃料电池代替,则该电池正极的电极反应式为 ______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铜为原料可制备应用广泛的氧化亚铜。
(1)向CuCl2溶液中通入SO2可得到CuCl沉淀,由CuCl水解再热分解可得到纳米Cu2O。CuCl水解为:CuCl(s)+H2O(l)![]() CuOH(s)+Cl-(aq)+H+(aq)。
CuOH(s)+Cl-(aq)+H+(aq)。
该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____________。
(2)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图所示。
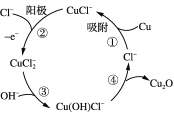
①阳极(反应②)的电极反应式为________________________________。
②电解一段时间后,电解液补充一定量的__________可完全恢复成原电解质溶液(填化学式)。
③溶液中③、④二步总反应的离子方程式为____________________________________。
(3)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g)![]() CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
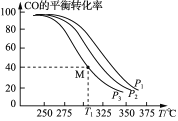
①该反应的ΔH_____0(填“<”或“>”),图中压强P1、P2、P3由大到小的关系是__________;
②起始时,甲容器中c(H2)=0.20 mol·L-1,c(CO)=0.10 mol·L-1,在P3及T1℃下反应达到平衡,此时反应的平衡常数为______(保留三位有效数字)。起始时,乙容器中c(H2)=0.40 mol·L-1,c(CO)=0.20 mol·L-1,T1℃下反应达到平衡,CO的平衡转化率______(填字母)。
A.大于40% B.小于40% C.等于40% D.等于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
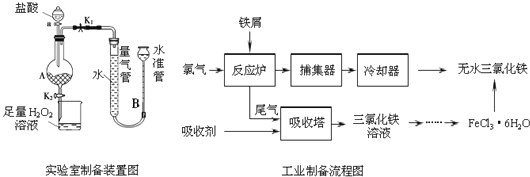
【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁,实验室制备装置和工业制备流程图如下:
已知:(1)无水FeCl3的熔点为555K、沸点为588K.
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl36H2O晶体.
请回答:
(1)烧杯中足量的H2O2溶液的作用是______________________。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是______________________。
(3)从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入______________后、_________________、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式:_____________________。
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为____________。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用cmolL-1Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-═2I-+S4O62-)。
①滴定终点的现象是:_____________________。
②样品中氯化铁的质量分数________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com