
【题目】以铜为原料可制备应用广泛的氧化亚铜。
(1)向CuCl2溶液中通入SO2可得到CuCl沉淀,由CuCl水解再热分解可得到纳米Cu2O。CuCl水解为:CuCl(s)+H2O(l)![]() CuOH(s)+Cl-(aq)+H+(aq)。
CuOH(s)+Cl-(aq)+H+(aq)。
该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____________。
(2)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图所示。
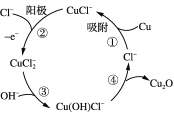
①阳极(反应②)的电极反应式为________________________________。
②电解一段时间后,电解液补充一定量的__________可完全恢复成原电解质溶液(填化学式)。
③溶液中③、④二步总反应的离子方程式为____________________________________。
(3)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g)![]() CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
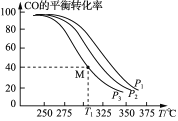
①该反应的ΔH_____0(填“<”或“>”),图中压强P1、P2、P3由大到小的关系是__________;
②起始时,甲容器中c(H2)=0.20 mol·L-1,c(CO)=0.10 mol·L-1,在P3及T1℃下反应达到平衡,此时反应的平衡常数为______(保留三位有效数字)。起始时,乙容器中c(H2)=0.40 mol·L-1,c(CO)=0.20 mol·L-1,T1℃下反应达到平衡,CO的平衡转化率______(填字母)。
A.大于40% B.小于40% C.等于40% D.等于80%
【答案】Kw×Ksp(CuCl)/Ksp(CuOH) CuCl--e-+Cl-=CuCl2 H2O 2CuCl2+2OH-=Cu2O↓+H2O+4Cl- < P1>P2>P3 46.3 A
【解析】
本题是一道综合题,以铜为载体考察了化学动力学、电化学的相关知识,难度一般。
(1)![]() ,
,![]() ,
,![]() ,
, ![]() ,因此很自然地可以看出
,因此很自然地可以看出![]() ;
;
(2)①据图可以看出,反应②中![]() 失去电子变成
失去电子变成![]() ,因此电极反应式为:
,因此电极反应式为:![]() ;
;
②据图可以发现,该电解池中仅仅消耗了水,根据“少谁补谁”的原则,只需向溶液中补充一定量的水就可完全恢复成原电解质溶液;
③第三步的方程为![]() ,第四步的方程为
,第四步的方程为![]() ,将两个方程式按2:1加和即得总反应方程式:
,将两个方程式按2:1加和即得总反应方程式:![]() ;
;
(3)①由图可以看出,温度越高则转化率越低,反应进行得越不彻底,因此正反应为放热反应;因为该反应是一个气体分子数减小的反应,所以压强越大反应得越彻底,根据图中可以看出:当温度相同时P1进行得最彻底,所以P1 > P2 > P3;
②已知条件下一氧化碳的转化率为40%,则达到平衡时一氧化碳的浓度为0.06mol/L,二氧化碳的浓度为0.12mol/L,甲醇的浓度为0.04mol/L,代入![]() =
=![]() =46.3;该体系是一个恒容体系,乙容器可以理解为甲容器达到平衡后再向容器中充入一定量的氢气和一氧化碳,装置内的压强增大后平衡会正向移动,所以乙装置中的平衡转化率将大于甲,大于40%。
=46.3;该体系是一个恒容体系,乙容器可以理解为甲容器达到平衡后再向容器中充入一定量的氢气和一氧化碳,装置内的压强增大后平衡会正向移动,所以乙装置中的平衡转化率将大于甲,大于40%。


科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应:aA(g)+bB(g)![]() cC(g)。其他条件不变时,改变某一条件对上述反应的影响,得到下列图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。下列分析正确的是
cC(g)。其他条件不变时,改变某一条件对上述反应的影响,得到下列图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。下列分析正确的是
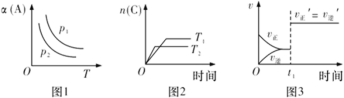
A.如图1反应:若p1>p2,则该反应只能在高温下自发进行
B.如图2反应:此反应的△H<0,且T1>T2
C.如图3反应:表示t1时刻可能是使用催化剂对反应速率的影响
D.如图3反应:表示t1时刻增大B的浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4 是二元弱酸,常温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-4下列溶液的离子浓度关系式正确的是
A.pH=2的H2C2O4溶液中,c(H+)=c(HC2O4-)=10-2mol/L
B.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
C.将NaOH溶液滴加到H2C2O4溶液中至混合溶液呈中性:c(C2O42-)>c(HC2O4-)
D.NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药用有机化合物A(C8H8O2)为一种无色液体。从A出发可发生如图所示的一系列反应。则下列说法正确的是
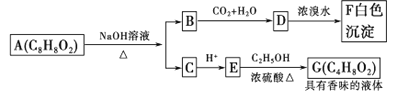
A.A的结构简式为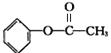
B.根据D和浓溴水反应生成白色沉淀可推知D为三溴苯酚
C.G的同分异构体中属于酯,且能发生银镜反应的只有一种
D.图中B→F与C→G发生反应的类型不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接甲醇燃料电池 (DMFC) 具备低温快速启动、燃料洁净环保以及电池结构简单等特性。这使得直接甲醇燃料电池(DMFC)可能成为未来便携式电子产品应用的主流。如图以甲醇为燃料的新型电池是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

(1)如图中的B极上的电极反应式为______。
(2)若用上述甲醇燃料电池做电源,用惰性电极电解100mL,5mol·L-1硫酸铜溶液,当阳极收集到3.36L(标准状况)气体时,消耗甲醇的质量为____g,此时可向电解后的溶液中加入_____使溶液复原。请写出电解硫酸铜溶液的电解反应化学方程式____。
(3)若用上述甲醇燃料电池做电源,用石墨做电极在一定条件下电解饱和食盐水制取NaOH。

①如图电解池的电极a接甲醇燃料电池的_____极( 填A或B) ,写出阳极的电极反应式:_____。假设电解时还产生一种黄绿色气体二氧氯(ClO2),写出阳极产生ClO2的电极反应式_________。
②电解一段时间,当阴极产生的气体体积为224 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的离子是( )
A.①③⑤⑦⑧B.②④⑥⑧C.①⑥D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果醋是一种由苹果汁发酵而成的酸性饮品,具有解毒、降脂等药效。苹果酸是一种常见的有机酸,其结构简式为![]() 。
。
(1)苹果酸的分子式为___。
(2)1mol苹果酸与足量金属钠反应,能生成标准状况下的氢气___L。
(3)苹果酸可能发生的反应是___(填序号)。
A.与NaOH溶液反应
B.与石蕊试液作用
C.与乙酸在一定条件下发生酯化反应
D.与乙醇在一定条件下发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,它可由咖啡酸合成,其合成过程如下。下列说法不正确的是
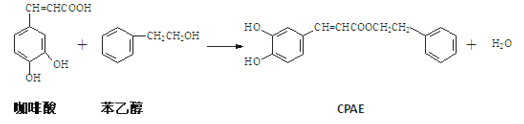
A. 咖啡酸的分子式为C9H8O4
B. 咖啡酸可发生加聚反应,并且所得聚合分子中含有3种官能团
C. 1 mol CPAE与足量的NaOH溶液反应,最多消耗3molNaOH
D. 1 mol CPAE与足量H2反应,最多消耗7 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于水溶液中的离子平衡问题叙述正确的是
A.将10mL0.1mol·L-1盐酸加入到10mL0.1mol·L-1碳酸钠溶液中:c(Na+)>c(Cl-)>c(HCO![]() )>c(CO
)>c(CO![]() )
)
B.某温度下0.1mol·L-1的醋酸pH为3,加水稀释10倍,则稀释后的溶液pH等于4
C.0.02mol·L-1HCN溶液与0.02mol·L-1NaCN溶液等体积混合c(HCN)+c(CN-)=0.04mol·L-1
D.向0.01mol·L-1醋酸溶液中加水,稀释后溶液中![]() 比值增大(忽略稀释过程中溶液温度变化)
比值增大(忽略稀释过程中溶液温度变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com