
【题目】CPAE是蜂胶的主要活性成分,它可由咖啡酸合成,其合成过程如下。下列说法不正确的是
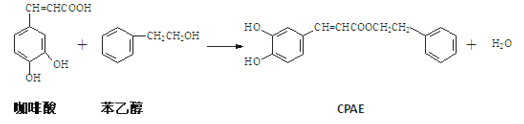
A. 咖啡酸的分子式为C9H8O4
B. 咖啡酸可发生加聚反应,并且所得聚合分子中含有3种官能团
C. 1 mol CPAE与足量的NaOH溶液反应,最多消耗3molNaOH
D. 1 mol CPAE与足量H2反应,最多消耗7 mol H2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则下列说法正确的是( )

A.电源B极是正极
B.(甲)(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铜为原料可制备应用广泛的氧化亚铜。
(1)向CuCl2溶液中通入SO2可得到CuCl沉淀,由CuCl水解再热分解可得到纳米Cu2O。CuCl水解为:CuCl(s)+H2O(l)![]() CuOH(s)+Cl-(aq)+H+(aq)。
CuOH(s)+Cl-(aq)+H+(aq)。
该反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____________。
(2)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图所示。
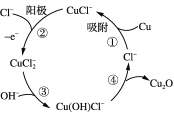
①阳极(反应②)的电极反应式为________________________________。
②电解一段时间后,电解液补充一定量的__________可完全恢复成原电解质溶液(填化学式)。
③溶液中③、④二步总反应的离子方程式为____________________________________。
(3)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g)![]() CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH=a kJ· mol-1。按n(H2)/n(CO)=2:1投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
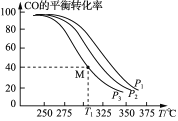
①该反应的ΔH_____0(填“<”或“>”),图中压强P1、P2、P3由大到小的关系是__________;
②起始时,甲容器中c(H2)=0.20 mol·L-1,c(CO)=0.10 mol·L-1,在P3及T1℃下反应达到平衡,此时反应的平衡常数为______(保留三位有效数字)。起始时,乙容器中c(H2)=0.40 mol·L-1,c(CO)=0.20 mol·L-1,T1℃下反应达到平衡,CO的平衡转化率______(填字母)。
A.大于40% B.小于40% C.等于40% D.等于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素对肿瘤细胞的杀伤有独特作用,其结构如图所示,下列有关叙述正确的是( )
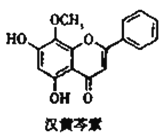
A. 汉黄芩素的分子式为C16H14O5
B. 1mol该物质与NaOH溶液反应,可消耗2molNaOH
C. 1mol该物质与溴水反应,最多消耗1molBr2
D. 该物质可发生取代、加成、缩聚、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷酸(H3AsO4)是三元弱酸,剧毒,可用于制备颜料、砷酸盐、杀虫剂等。常温下,其溶液中含砷的各微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与pH的关系如图所示。在常温下,下列说法错误的是
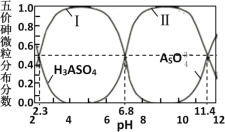
A.曲线Ⅱ代表HAsO![]() 的分布分数
的分布分数
B.该砷酸溶液:Ka2/Ka3=104.6
C.等物质的量浓度的H3AsO4溶液和NaOH溶液等体积混合后所得溶液:pH>7
D.0.1mol/L的Na2HAsO4溶液中: c(HAsO![]() )> c(H2AsO
)> c(H2AsO![]() )> c(AsO
)> c(AsO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁,实验室制备装置和工业制备流程图如下:
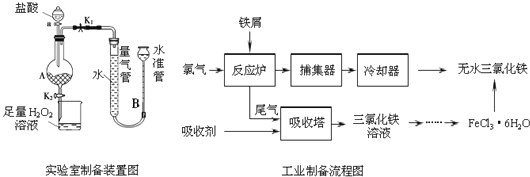
已知:(1)无水FeCl3的熔点为555K、沸点为588K.
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl36H2O晶体.
请回答:
(1)烧杯中足量的H2O2溶液的作用是______________________。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是______________________。
(3)从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入______________后、_________________、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式:_____________________。
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为____________。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用cmolL-1Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-═2I-+S4O62-)。
①滴定终点的现象是:_____________________。
②样品中氯化铁的质量分数________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体4.48L(气体体积均在标准状况下测定,下同),这些气体与一定体积氧气混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是60mL。下列说法不正确的是![]()
![]()
A.此反应过程中转移的电子为0.6mol
B.消耗氧气的体积是1.68L
C.混合气体中含NO23.36L
D.参加反应的硝酸是0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理。
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①Na2CO3俗称纯碱,因CO![]() 水解而使其水溶液呈碱性,写出CO
水解而使其水溶液呈碱性,写出CO![]() 第一步水解的离子方程式:_________________________________________________________________。
第一步水解的离子方程式:_________________________________________________________________。
已知25 ℃时,CO![]() 第一步水解的平衡常数Kh=2×10-4 mol·L-1,当溶液中c(HCO
第一步水解的平衡常数Kh=2×10-4 mol·L-1,当溶液中c(HCO![]() )∶c(CO
)∶c(CO![]() )=20∶1时,溶液的pH=________。
)=20∶1时,溶液的pH=________。
②泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式: _____________________________________________________________。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1 CH3COONa溶液,则两份溶液中c(NO![]() )、c(NO
)、c(NO![]() ) 和c(CH3COO-)由大到小的顺序为____________________,(已知HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)。可使溶液A和溶液B的pH相等的方法是________。
) 和c(CH3COO-)由大到小的顺序为____________________,(已知HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)。可使溶液A和溶液B的pH相等的方法是________。
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com