
����Ŀ���Ȼ����dz�����ˮ�����������÷���м���Ʊ���ˮ�Ȼ�����ʵ�����Ʊ�װ�ú�ҵ�Ʊ�����ͼ���£�
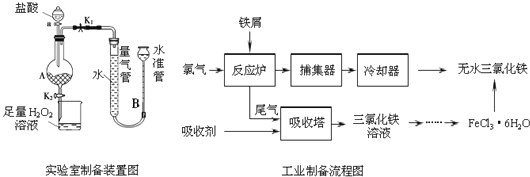
��֪����1����ˮFeCl3���۵�Ϊ555K���е�Ϊ588K��
��2������м�е����ʲ������ᷴӦ
��3����ͬ�¶�����ˮ���Ȼ�����ˮ�е��ܽ�����£�
�¶�/�� | 0 | 20 | 80 | 100 |
�ܽ�ȣ�g/100g H2O�� | 74.4 | 91.8 | 525.8 | 535.7 |
ʵ�����Ʊ������������£�
�������ɼ�K1���رյ��ɼ�K2��������a�������μ����ᣮ
��������ʱ���رյ��ɼ�K1�����ɼ�K2����A����Һ��ȫ�����ձ���رջ���a��
�������ձ�����Һ����һϵ�в�����õ�FeCl36H2O���壮
��ش�
��1���ձ���������H2O2��Һ��������______________________��
��2��Ϊ�˲ⶨ����м�����������������������С�������������______________________��
��3����FeCl3��Һ�Ƶ�FeCl36H2O����IJ��������ǣ�����______________��_________________������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����
��4����д���������з�Ӧ�����ӷ���ʽ��_____________________��
��5���������¶ȳ���673Kʱ��������Է�������Ϊ325�������Ȼ�������ʵķ���ʽΪ____________��
��6��FeCl3����������ͨ�����õ������ⶨ����ȡm g��ˮ�Ȼ�����Ʒ������ϡ���ᣬ���Ƴ�100mL��Һ��ȡ��10.00mL�������Թ�����KI��Һ����ַ�Ӧ���뼸�ε�����Һ������cmolL-1Na2S2O3��Һ�ζ�������V mL����֪��I2+2S2O32-�T2I-+S4O62-����
���ζ��յ�������ǣ�_____________________��
����Ʒ���Ȼ�������������________________��
���𰸡�����������ȫ������������������ װ��A�в��������ݻ������ܺ�ˮ��Һ�治�䣨����������Ҳ���֣� ���� ����Ũ������ȴ�ᾧ 2Fe2++Cl2=2Fe3++2Cl- Fe2Cl6 ��Һ����ɫ����ɫ���Ұ�����ڲ���ɫ ![]()
��������
ʵ�����Ʊ��У�����м�����ᷴӦ�õ�FeCl2��FeCl2����H2O2��Ӧ�õ�FeCl3��6H2O���ڹ�ҵ�Ʊ��У���м��������Ӧ�õ�FeCl3�����������õ�FeCl3��6H2O��
��1������ʵ��װ�úͲ��������֪��ʵ�����Ʊ���ˮFeCl3���������������ᷴӦ����FeCl2��Ȼ���FeCl2������FeCl3�����Ƶ�FeCl36H2O���壬���ѽᾧˮ�Ƶ���ˮFeCl3���ձ���������H2O2��Һ��������������FeCl2������FeCl3����Fe2��ȫ��������Fe3����
��2���������ᷴӦ��ȫʱ�����ٲ�������������װ��A�в��������ݻ������ܺ�ˮ�ܵ�Һ�治�ٱ仯����ʱ���ɽ�A��FeCl2��Һ�����ձ��н���������
��3����FeCl3��6H2O�ڲ�ͬ�¶��µ��ܽ�ȿ��Կ����������¶ȵı仯���ܽ�ȱ仯�ܴ���˲��ý��½ᾧ�ķ����õ����塣��FeCl3��Һ�Ƶ�FeCl36H2O����IJ��������ǣ�����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����
��4���ӹ�ҵ�Ʊ�����ͼ������֪����Ӧ¯�н��еķ�Ӧ�� 2Fe+3Cl2=2FeCl3����ˣ������������е�β����û�вμӷ�Ӧ���������������������������ռ����գ���Ӧ������2FeCl3��Һ���������ռ�Ӧ��2FeCl2��Һ����Ӧ�����ӷ���ʽΪ��2Fe2++Cl2=2Fe3++2Cl-��
��5���������ռ�������̬FeCl3��FeCl3����Է���������162.5������Է�������Ϊ325�������Ȼ�������Ƴ������¶ȳ���673Kʱ����������̬FeCl3���Ծۺ�����˫����Fe2Cl6��
��6������ȡm g��ˮ�Ȼ�����Ʒ������ϡ���ᣬ���Ƴ�100mL��Һ��ȡ��10.00mL�������Թ�����KI��Һ����ַ�Ӧ���뼸�ε�����Һ����ʱ��Һ����ɫ���� Na2S2O3��Һ�ζ����������һ��Na2S2O3��Һ����ƿ�ڵ���Һ����ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ�����Եζ��յ�������ǣ���Һ����ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ��
���ɷ�Ӧ��2Fe3++2I-=2Fe2++I2�� I2+2S2O32-�T2I-+S4O62-���ɵù�ϵʽ��
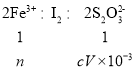
���n(Fe3+)=cV��10-3mol������Ʒ���Ȼ�������������Ϊ��
��(Fe3+)= ![]() =
=![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2C2O4 �Ƕ�Ԫ���ᣬ�����£�Ka1(H2C2O4)=5.4��10-2��Ka2(H2C2O4)=5.4��10-4������Һ������Ũ�ȹ�ϵʽ��ȷ����
A.pH��2��H2C2O4��Һ�У�c(H+)=c(HC2O4-)=10-2mol/L
B.pH��2��H2C2O4��Һ��pH��12��NaOH��Һ���������ϣ�c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
C.��NaOH��Һ�μӵ�H2C2O4��Һ���������Һ�����ԣ�c(C2O42-)��c(HC2O4-)
D.NaHC2O4��Һ�У�c(Na+)��c(HC2O4-)��c(H2C2O4)��c(C2O42-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƻ������һ����ƻ��֭���Ͷ��ɵ�������Ʒ�����нⶾ����֬��ҩЧ��ƻ������һ�ֳ������л��ᣬ��ṹ��ʽΪ![]() ��
��
��1��ƻ����ķ���ʽΪ___��
��2��1molƻ���������������Ʒ�Ӧ�������ɱ�״���µ�����___L��
��3��ƻ������ܷ����ķ�Ӧ��___������ţ���
A.��NaOH��Һ��Ӧ
B.��ʯ����Һ����
C.��������һ�������·���������Ӧ
D.���Ҵ���һ�������·���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CPAE�Ƿ佺����Ҫ���Գɷ֣������ɿ�����ϳɣ���ϳɹ������¡�����˵������ȷ����
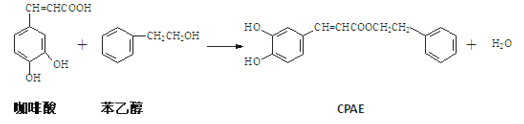
A. ������ķ���ʽΪC9H8O4
B. ������ɷ����Ӿ۷�Ӧ���������þۺϷ����к���3�ֹ�����
C. 1 mol CPAE��������NaOH��Һ��Ӧ���������3molNaOH
D. 1 mol CPAE������H2��Ӧ���������7 mol H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ�������ж���ȷ����( )
A.0.1mol H2��0.1mol I2���ܱ������г�ַ�Ӧ�����������Ϊ0.2NA
B.30g����(C2H6)���й��ۼ�����Ϊ6NA
C.1L 1mol��L-1��(NH4)2SO4��Һ�к��е�NH4����ĿΪ2NA
D.�����£���2.7g��ƬͶ�����Ũ�����г�ַ�Ӧת�Ƶ�����Ϊ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ʵ��װ�ÿ������ⶨ������Ԫ�ص�ij������X�ķ���ʽ����ע����A��װ��240mL����X����ͨ������������װ�к��ȵ�����ͭ�IJ�����B��ʹ֮��ȫ��Ӧ���õ������ʵ������ʵ��ǰB����20.32g��ʵ���B����20.00g��B���еĺ�ɫ��ĩ��ɺ�ɫ��ĩ����C�����ռ�����ɫҺ����ˮ����ע����D���ռ��������ǵ������Իش��������⣺

(1)X��������______��______Ԫ����ɵġ�
(2)��240mL X������ȫ��Ӧ���ռ���������������0.28g������ʵ��ʱ���¶Ⱥ�ѹǿ����1molX������������24000mL����X��Ħ��������______g/mol��
(3)ͨ�����㣬ȷ��X�ķ���ʽΪ______��
(4)д��B�з�����Ӧ�Ļ�ѧ����ʽ(X�ڸ������²������ֽⷴӦ)______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(N2H4)�ǻ����������ȼ�ϣ�����N2O4��Ӧ���ɵ�����ˮ��������֪��
��N2(g)��2O2(g)===N2O4(g)��H����8.7 kJ��mol��1
��N2H4(g)��O2(g)===N2(g)��2H2O(g)��H����534.0 kJ��mol��1
���б�ʾ�¸�N2O4��Ӧ���Ȼ�ѧ����ʽ��ȷ����
A.2N2H4(g)��N2O4(g)===3N2(g)��4H2O(g) ��H����542.7 kJ��mol��1
B.2N2H4(g)��N2O4(g)===3N2(g)��4H2O(g) ��H����1 076.7 kJ��mol��1
C.N2H4(g)��![]() N2O4(g)===
N2O4(g)===![]() N2(g)��2H2O(g) ��H����1 076.7 kJ��mol��1
N2(g)��2H2O(g) ��H����1 076.7 kJ��mol��1
D.2N2H4(g)��N2O4(g)===3N2(g)��4H2O(g) ��H����1 059.3 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ˮ��Һ�е�����ƽ������������ȷ����
A.��10mL0.1mol��L��1������뵽10mL0.1mol��L��1̼������Һ�У�c(Na��)��c(Cl��)��c(HCO![]() )��c(CO
)��c(CO![]() )
)
B.ij�¶���0.1mol��L��1�Ĵ���pHΪ3����ˮϡ��10������ϡ�ͺ����ҺpH����4
C.0.02mol��L��1HCN��Һ��0.02mol��L��1NaCN��Һ��������c(HCN)��c(CN��)��0.04mol��L��1
D.��0.01mol��L��1������Һ�м�ˮ��ϡ�ͺ���Һ��![]() ��ֵ������ϡ��������Һ�¶ȱ仯��
��ֵ������ϡ��������Һ�¶ȱ仯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���![]() ��Һ�ζ�
��Һ�ζ�![]() ��Һ��������ͼ��ʾ������˵���������
��Һ��������ͼ��ʾ������˵���������
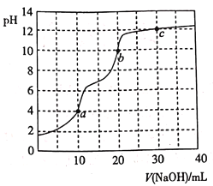
A.�ζ��յ�a��ѡ�������ָʾ��
B.c����Һ��![]()
C.b����Һ��![]()
D.a��b��c������ˮ�ĵ���̶�������c
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com