
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是( )
A.0.1mol H2和0.1mol I2在密闭容器中充分反应后,其分子总数为0.2NA
B.30g乙烷(C2H6)含有共价键总数为6NA
C.1L 1mol·L-1的(NH4)2SO4溶液中含有的NH4+数目为2NA
D.常温下,将2.7g铝片投入过量浓硝酸中充分反应转移电子数为0.3NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ、在水的电离平衡中,c(H+)和 c(OH-)的关系如图所示:
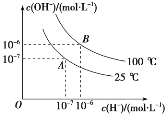
(1)100 ℃时,若向水中滴加盐酸,___(填“能”或“不能”)使体系处于 B 点状态。
(2)25 ℃时,将 pH=9 的 NaOH 溶液与 pH=4 的硫酸溶液混合,所得混合溶液的 pH=7,则 NaOH 溶液与硫酸溶液的体积比为___。
(3)100 ℃时,若盐酸中c(H+)=5×10-5 mol·L-1,则由水电离产生的 c(H+)=____。
Ⅱ、已知在 25 ℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为醋酸K=1.75×10-5,次氯酸 K=2.95×10-8,碳酸 K1=4.30×10-7 ,K2=5.61×10-11,亚硫酸K1=1.54×10-2,K2=1.02×10-7
(4)写出碳酸的第一级电离平衡常数表达式K1=___。
(5)在相同条件下,等浓度的 CH3COONa、NaClO、Na2CO3、NaHCO3、Na2SO3 和 NaHSO3 溶液中碱性最强的是_____。等浓度的 Na2CO3 和 NaHCO3 的混合溶液中各离子浓度大小顺序为______。
(6)若保持温度不变,在醋酸溶液中通入少量 HCl(g),下列量会变小的是_____(填字母序号,下同)。
a.c(CH3COO-) b.c(H+) c.醋酸的电离平衡常数 d.c(CH3COOH)
(7)下列离子方程式中错误的是_____。
a 少量 CO2 通入次氯酸钠溶液中:CO2+H2O+ClO-=HCO![]() +HClO
+HClO
b 少量 SO2 通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
c 过量 CO2 通入澄清石灰水中:CO2+OH-=HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素对肿瘤细胞的杀伤有独特作用,其结构如图所示,下列有关叙述正确的是( )
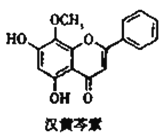
A. 汉黄芩素的分子式为C16H14O5
B. 1mol该物质与NaOH溶液反应,可消耗2molNaOH
C. 1mol该物质与溴水反应,最多消耗1molBr2
D. 该物质可发生取代、加成、缩聚、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电板上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是
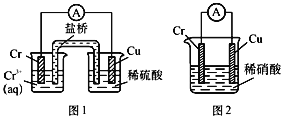
A. 图1为原电池装置,盐桥中的阴离子移向Cu电极的烧杯中
B. 由实验现象可知:金属活动性Cu>Cr
C. 图2装置中Cu电极上发生的电极反应式为:Cu-2e-=Cu2+
D. 两个装置中,电子均由Cr电极流向Cu电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁,实验室制备装置和工业制备流程图如下:
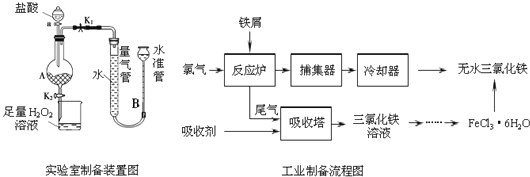
已知:(1)无水FeCl3的熔点为555K、沸点为588K.
(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl36H2O晶体.
请回答:
(1)烧杯中足量的H2O2溶液的作用是______________________。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是______________________。
(3)从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入______________后、_________________、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式:_____________________。
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为____________。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用cmolL-1Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-═2I-+S4O62-)。
①滴定终点的现象是:_____________________。
②样品中氯化铁的质量分数________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,重水( D2O)的离子积常数为1.6×10-15,若用定义pH一样规定pD= -lgc(D+),则在该温度下,下列叙述正确的是
A. 纯净的重水中,c(D+) ·c(OD-)>1.0×10-14
B. l L溶解有0.01 mol DCl的重水溶液,其pD=2
C. 1 L溶解有0. 01 mol NaOD的重水溶液,其pD=12
D. 纯净的重水中,pD=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法是目前“海水提溴”使用到的主要方法之一。其工艺流程如下:
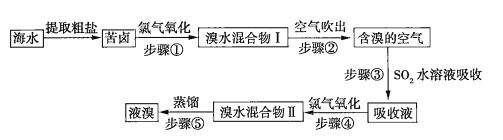
(1)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过___________(填化合物名称)溶液,以除去氯气。
(2)步骤⑤的蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因_____________。
(3)步骤①中用硫酸酸化可提高![]() 的利用率,理由是__________。
的利用率,理由是__________。
(4)提取溴单质时,蒸馏溴水混合物Ⅱ而不是蒸馏溴水混合物Ⅰ,请说明原因:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.12g金刚石中含有的共价键数为4NA
B.7g超重甲基(—CT3)中含有的电子数为3NA
C.标准状况下,22.4L氩气中含有的原子数约为2NA
D.0.1molNa2O2与SO2完全反应转的电子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com