
【题目】空气吹出法是目前“海水提溴”使用到的主要方法之一。其工艺流程如下:
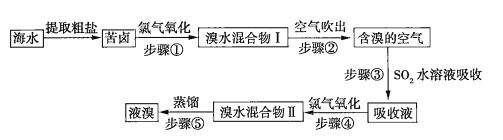
(1)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过___________(填化合物名称)溶液,以除去氯气。
(2)步骤⑤的蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因_____________。
(3)步骤①中用硫酸酸化可提高![]() 的利用率,理由是__________。
的利用率,理由是__________。
(4)提取溴单质时,蒸馏溴水混合物Ⅱ而不是蒸馏溴水混合物Ⅰ,请说明原因:_________。
【答案】溴化铁 温度过高,大量水被蒸出;温度过低,溴不能被完全蒸出 酸化可抑制![]() 、
、![]() 与水反应 将溴水混合物Ⅰ转变为溴水混合物Ⅱ是
与水反应 将溴水混合物Ⅰ转变为溴水混合物Ⅱ是![]() 的富集浓缩过程,蒸馏溴水混合物Ⅱ可提高效率,减少能耗,降低成本
的富集浓缩过程,蒸馏溴水混合物Ⅱ可提高效率,减少能耗,降低成本
【解析】
从海水中提取澳,一般要经过浓缩、氧化、提取三个步骤。步骤①发生的反应是![]() ,生成的溴仍溶解在海水中,依裾澳的沸点比水的低,鼓入热空气(步骤②),使溴挥发出来,再用
,生成的溴仍溶解在海水中,依裾澳的沸点比水的低,鼓入热空气(步骤②),使溴挥发出来,再用![]() 水溶液吸收(步骤③):
水溶液吸收(步骤③):![]() ,这样可以得到
,这样可以得到![]() 浓度较大的溶液,进一步用氯气氧化(步骤④),可得到含
浓度较大的溶液,进一步用氯气氧化(步骤④),可得到含![]() 的水溶液,然后蒸馏即得到液溴。
的水溶液,然后蒸馏即得到液溴。
(1)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过溴化铁溶液,发生反应![]() ,以除去氯气,
,以除去氯气,
故答案为:溴化铁;
(2)步骤⑤的蒸馏过程中,温度应控制在80~90℃,温度过高,大量水被蒸出;温度过低,溴不能被完全蒸出,
故答案为:温度过高,大量水被蒸出;温度过低,溴不能被完全蒸出;
(3)![]() ,
,![]() 加入硫酸酸化可以使平衡左移,可抑制
加入硫酸酸化可以使平衡左移,可抑制![]() 、
、![]() 与水反应,提高
与水反应,提高![]() 的利用率,
的利用率,
故答案为:酸化可抑制![]() 、
、![]() 与水反应;
与水反应;
(4)提取溴单质时,蒸馏溴水混合物Ⅱ而不是蒸馏溴水混合物Ⅰ原因是将溴水混合物Ⅰ转变为溴水混合物Ⅱ是![]() 的富集浓缩过程,蒸馏溴水混合物Ⅱ可提高效率,减少能耗,降低成本,
的富集浓缩过程,蒸馏溴水混合物Ⅱ可提高效率,减少能耗,降低成本,
故答案为:将溴水混合物Ⅰ转变为溴水混合物Ⅱ是![]() 的富集浓缩过程,蒸馏溴水混合物Ⅱ可提高效率,减少能耗,降低成本。
的富集浓缩过程,蒸馏溴水混合物Ⅱ可提高效率,减少能耗,降低成本。


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】直接甲醇燃料电池 (DMFC) 具备低温快速启动、燃料洁净环保以及电池结构简单等特性。这使得直接甲醇燃料电池(DMFC)可能成为未来便携式电子产品应用的主流。如图以甲醇为燃料的新型电池是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

(1)如图中的B极上的电极反应式为______。
(2)若用上述甲醇燃料电池做电源,用惰性电极电解100mL,5mol·L-1硫酸铜溶液,当阳极收集到3.36L(标准状况)气体时,消耗甲醇的质量为____g,此时可向电解后的溶液中加入_____使溶液复原。请写出电解硫酸铜溶液的电解反应化学方程式____。
(3)若用上述甲醇燃料电池做电源,用石墨做电极在一定条件下电解饱和食盐水制取NaOH。

①如图电解池的电极a接甲醇燃料电池的_____极( 填A或B) ,写出阳极的电极反应式:_____。假设电解时还产生一种黄绿色气体二氧氯(ClO2),写出阳极产生ClO2的电极反应式_________。
②电解一段时间,当阴极产生的气体体积为224 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是( )
A.0.1mol H2和0.1mol I2在密闭容器中充分反应后,其分子总数为0.2NA
B.30g乙烷(C2H6)含有共价键总数为6NA
C.1L 1mol·L-1的(NH4)2SO4溶液中含有的NH4+数目为2NA
D.常温下,将2.7g铝片投入过量浓硝酸中充分反应转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭发动机的燃料,它与N2O4反应生成氮气和水蒸气。已知:
①N2(g)+2O2(g)===N2O4(g)ΔH=+8.7 kJ·mol-1
②N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534.0 kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式正确的是
A.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-542.7 kJ·mol-1
B.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 076.7 kJ·mol-1
C.N2H4(g)+![]() N2O4(g)===
N2O4(g)===![]() N2(g)+2H2O(g) ΔH=-1 076.7 kJ·mol-1
N2(g)+2H2O(g) ΔH=-1 076.7 kJ·mol-1
D.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 059.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O,Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2Pb(BF4)2+2H2O,Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A. 放电时,负极反应为:PbO2+4HBF4-2e-=Pb(BF4)2+2BF4-+2H2O
B. 充电时,当正极质量减少23.9g时转移0.2mol电子
C. 放电时,PbO2电极附近溶液的pH增大
D. 充电时,Pb电极的电极反应式为PbO2+4H++2e-=Pb2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于水溶液中的离子平衡问题叙述正确的是
A.将10mL0.1mol·L-1盐酸加入到10mL0.1mol·L-1碳酸钠溶液中:c(Na+)>c(Cl-)>c(HCO![]() )>c(CO
)>c(CO![]() )
)
B.某温度下0.1mol·L-1的醋酸pH为3,加水稀释10倍,则稀释后的溶液pH等于4
C.0.02mol·L-1HCN溶液与0.02mol·L-1NaCN溶液等体积混合c(HCN)+c(CN-)=0.04mol·L-1
D.向0.01mol·L-1醋酸溶液中加水,稀释后溶液中![]() 比值增大(忽略稀释过程中溶液温度变化)
比值增大(忽略稀释过程中溶液温度变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:

已知:RX![]() ROH;RCHO+CH3COOR’
ROH;RCHO+CH3COOR’![]() RCH=CHCOOR’
RCH=CHCOOR’
请回答:
(1)E中官能团的名称是_________。
(2)B+D→F的化学方程式_________。
(3)X的结构简式_________。
(4)对于化合物X,下列说法正确的是_________。
A.能发生水解反应 B.不与浓硝酸发生取代反应
C.能使Br2/CCl4溶液褪色 D.能发生银镜反应
(5)下列化合物中属于F的同分异构体的是_________。
A.![]() B.
B.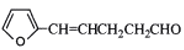
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种电镀废水含A阴离子,排放前的处理过程如下:
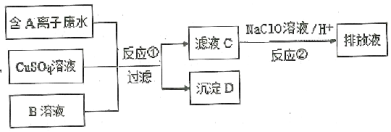
己知:4.5g沉淀D在氧气中灼烧后,产生4.0g黑色固体,生成的无色无味气体通过足量澄清石灰水时,产生5.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标准状况下密度为1.25g·L-1的单质气体E 560mL。
(1)E的结构式为____________。
(2)写出沉淀D在氧气中灼烧发生的化学方程式_______________________________。
(3)溶液B具有性质____________(填“氧化性”或“还原性”)。
(4)滤液C中还含有微量的A离子,通过反应②,可将其转化为对环境无害的物质,用离子方程式表示该反应为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com